Химия - один из наиболее важных предметов в школе. Удивительный мир веществ и соединений, а также красочные и интересные опыты, которые показывает преподаватель, очаровывают всех детей, заставляя проявлять определенный интерес к таинственной науке. В данной статье обратим внимание на процесс электролитической диссоциации, а конкретнее на слабые и сильные электролиты.
Чтобы дать развернутый ответ на вопрос, что же относится к сильным электролитам, а что - к слабым, надо для начала разобраться, что такое диссоциация веществ.
Электролитическая диссоциация
 Вам будет интересно:Дефиле от кутюр. Что такое "кутюр"
Вам будет интересно:Дефиле от кутюр. Что такое "кутюр"
Различные химические соединения, например, соли или кислоты растворяются в воде, распадаясь до элементарных частиц: ионов, эту реакцию и принято называть электрической диссоциацией. Соединения, которые растворяются, распадаясь на ионы, в свою очередь называются электролитами.
Так еще называются соединения, способные проводить электрический ток, а вещества, не наделенные данной способностью, соответственно, называют неэлектролитами.
Процесс диссоциации является обратимым, поэтому на письме обозначается двумя стрелками с противоположными направлениями, написанными друг под другом. Полученный раствор обладает способностью проведения электрического тока.
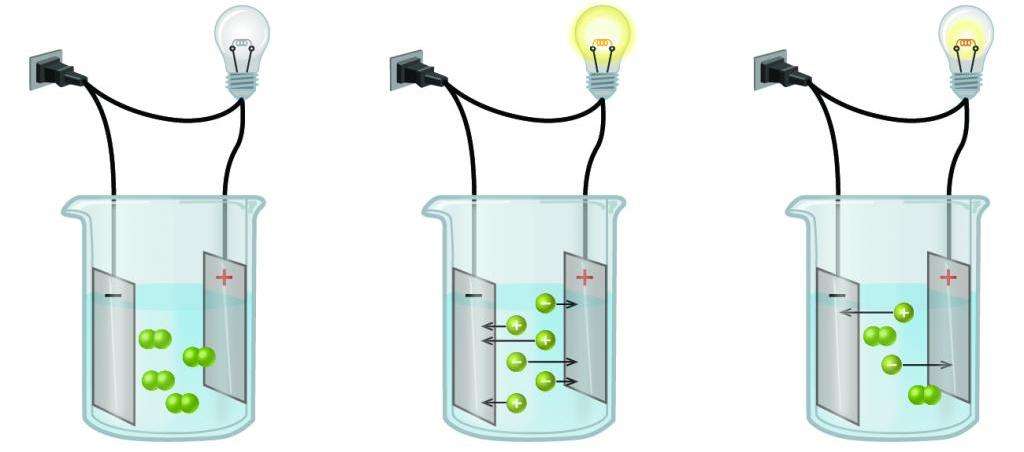
Электрический ток - это скоординированное движение свободных частиц, обладающих зарядом, которое имеет определенное направление. Электрический ток в металлах проходит с помощью относительно свободных электронов, но в данном случае речь пойдет не о металлах.
Кроме того, ионы, на которые распалось вещество имеют различный заряд. Здесь необходимо ввести еще два термина по данной теме: катионы и анионы. Катионы - это ионы с положительным зарядом, а анионы же наоборот - с отрицательным.
Количественная характеристика процесса
Так как в дальнейшем речь пойдет именно о водных соединениях, то необходимо ввести понятие раствор. Согласно физической теории, раствор - это механическая часть составляющих без какого-либо допустимого взаимодействия молекул. Однако, давая ответ на вопрос, что относится к сильным электролитам, данная версия не имеет объяснения именно для электролитических растворов. Поэтому обратимся к химическому взгляду на данное понятие.
Раствор представляет собой химическую реакцию, подтверждаемую, например, выделением тепла или изменением цвета раствора, между растворителем (в данном случае вода) и растворенном в нем веществе (в данном случае электролит). Современная наука же считает, что это понятие можно характеризовать как физическим, так и химическим определением, ведь оба они по сути являются верными.

Для того чтобы численно характеризовать диссоциацию разных соединений, было решено использовать понятие "электролитическая степень диссоциации вещества", помогающая понять, какие вещества относятся к сильным электролитам, а какие - к слабым. Это характеризующее число вычисляется по формуле как частное количество распавшихся на ионы молекул к суммарному их количеству в веществе. Соответственно, если это значение приближено к единице, то соединение относится к сильным электролитам, так как преимущественное большинство молекул прошли диссоциацию. Как правило, в химических реакциях с сильными электролитами принято писать знак "равно", так как она не является обратимой.
Сильные электролиты
К сильным электролитам относится:
- Соли, растворимые в воде. Эту информацию можно получить, открыв таблицу растворимости.
- Неорганические кислоты, относящиеся к сильным электролитам, такие как H2SO4, HCl, HNO3 и другие.
- Гидроксиды соединений металлов, а также основания, такие как LiOH, Ba(OH)2 и другие.
Слабые электролиты
Определившись, что относится к сильным электролитам, стоит поговорить и об их противоположности - слабых электролитах, плохо диссоциирующихся в воде.
К ним относится:
- Неорганические кислоты, такие как H2CO3, H2S, HNO2 и другие.
- Многие органические кислоты.
- Гидроксиды металлов, которые не растворяются в воде. Информацию об этом можно узнать, открыв таблицу растворимости.
- Вода.
Заключение
Будем надеяться, что данная статья оказалась вам полезной, и вы получили развернутый ответ на вопрос, что относится к сильным электролитам, а что - к слабым. В любом случае хотим вам пожелать успехов в дальнейшем изучении удивительного мира химии, который может показаться магией только в самом начале. А при дальнейшем обучении вы самостоятельно сможете творить чудеса, удивляя всех вокруг себя.