Ученые начали исследовать поведение газов при различных внешних условиях со второй половины XVII века. В течение почти двух веков были экспериментально открыты основные газовые законы в физике, анализируя которые Эмиль Клапейрон в 1834 году записал универсальное уравнение состояния. Рассмотрим подробнее в статье эти законы.
Идеальные газы
Прежде чем переходить к описанию законов газов в физике, дадим характеристику модели, на которую они опираются. Речь идет о модели идеального газа. Согласно ей, рассматриваемое агрегатное состояние материи состоит из невзаимодействующих друг с другом частиц (атомов и молекул), которые полагают безразмерными. Частицы движутся со скоростями несколько сотен метров в секунду в разных направлениях. Их средняя кинетическая энергия характеризует температуру всей системы, а столкновения со стенками сосуда приводят к появлению давления в ней.
 Вам будет интересно:Мусор в космосе вокруг Земли: откуда берется и чем опасен
Вам будет интересно:Мусор в космосе вокруг Земли: откуда берется и чем опасен
Поведение реальных газов, которые находятся при не слишком больших давлениях и температурах в несколько сотен кельвин, хорошо согласуется с предсказаниями описанной модели. Например, земной воздух можно считать идеальной смесью газов.
Закон Бойля-Мариотта

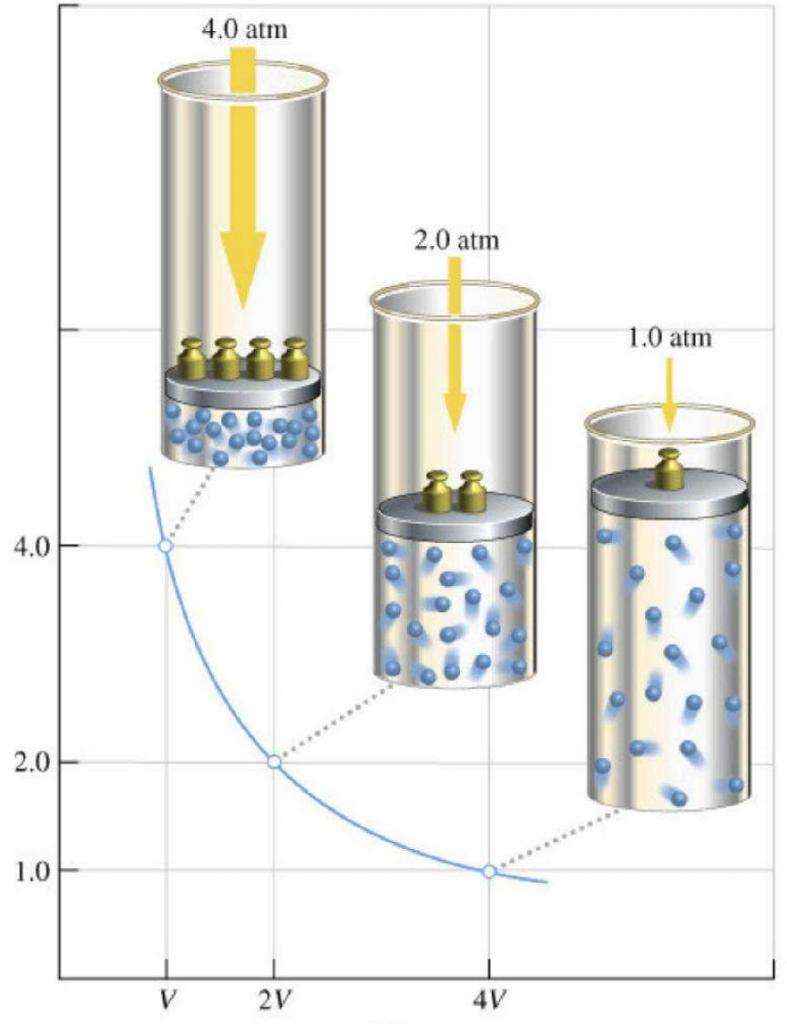
Рассматривая с точки зрения термодинамики газы, газовый закон Роберта Бойля и Эдма Мариотта следует назвать в первую очередь, поскольку он был экспериментально открыт раньше всех остальных законов (вторая половина XVII века). Он гласит, что при постоянной температуре в закрытой газовой системе любое изменение объема приводит к обратно пропорциональному изменению давления. Математически закон записывается в следующих двух формах:
P*V = const при T = const;
P1*V1 = P2*V2.
График закона Бойля-Мариотта называется изотермой. Она представляет собой гиперболическую зависимость функций P(V) или V(P).
Законы Шарля и Гей-Люссака
Оба закона газов в физике были открыты примерно в одно и то же время (конец XVIII - начало XIX веков) французами Шарлем и Гей-Люссаком.
Закон Шарля описывает поведение газовой системы во время изобарного процесса, то есть перехода между равновесными состояниями при постоянном давлении. Закон гласит, что при увеличении температуры в указанных условиях объем растет прямо пропорционально. Математически его записывают следующим образом:
V/T = const при P = const;
V1/T1 = V2/T2.
Закон Шарля можно получить экспериментально, если в цилиндр под подвижный поршень закачать некоторый объем газа, а затем нагревать систему и фиксировать в ней температуру и объем.
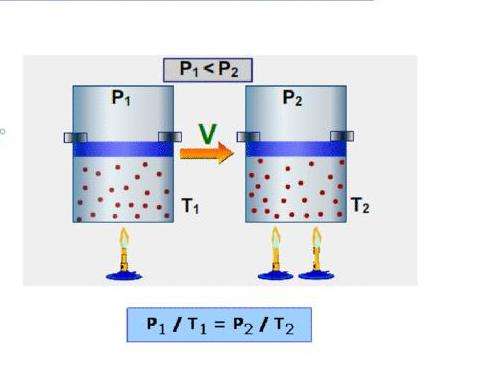
Третий основной газовый закон носит фамилию Гей-Люссака. Он описывает поведение системы во время изохорного процесса, то есть при постоянном объеме. Если в предыдущем случае газ закачивался в цилиндр с подвижным поршнем, то в законе Гей-Люссака объем цилиндра фиксирован. Изменяются лишь давление и температура. Математически его выражают так:
P/T = const при V = const;
P1/T1 = P2/T2.
Видно, что эта зависимость ничем не отличается от предыдущей. Только в данном случае вместо величины V стоит P.
Графики изобары (P=const) и изохоры (V=const) представляют собой прямые линии с положительным наклоном, поскольку увеличение объема (давления) всегда приводит к возрастанию абсолютной температуры. Важно запомнить, что приведенные в этом пункте формулы справедливы только в том случае, если в них использовать температуру в единицах абсолютной шкалы, то есть в кельвинах.
Закон или принцип Авогадро
В начале того же XIX века итальянец Амедео Авогадро, исследуя поведение разных газов, взятых в разных количествах, пришел к удивительному заключению. Ученый показал экспериментально, что разные газы при одинаковых давлениях и температурах занимают объем, пропорциональный количеству вещества в молях. В виде формулы этот принцип представляется так:
n/V = const при T, P = const;
n1/V1 = n2/V2.
Важный вывод, который можно сделать из этого закона газов в физике, заключается в отсутствии в нем зависимости от химического состава. Отметим, что на принципе Авогадро основан закон парциальных давлений для смеси идеальных газов, который носит фамилию Дальтона.
Закон Клапейрона-Менделеева

Он также называется законом состояния газов и обобщает экспериментальный опыт всех предыдущих законов. Соответствующее уравнение впервые записал Эмиль Клапейрон в 1834 году, а Менделеев ввел постоянную универсальную для газов R. Уравнение Клапейрона-Менделеева имеет вид:
P*V = n*R*T.
Каждый школьник может получить из него любой из перечисленных выше законов газов в физике, если зафиксирует две соответствующие переменные.