Из четырех агрегатных состояний вещества, пожалуй, газ является самым простым с точки зрения его физического описания. В статье рассмотрим приближения, которые используются для математического описания реальных газов, а также приведем так называемое уравнение Клапейрона.
Идеальный газ
Все газы, с которыми мы встречаемся в течение жизни (природный метан, воздух, кислород, азот и так далее), можно отнести к категории идеальных. Идеальным называют любое газовое состояние вещества, в котором частицы хаотически движутся в разных направлениях, их столкновения являются 100% упругими, частицы друг с другом не взаимодействуют, они являются материальными точками (имеют массу и не имеют объема).
 Вам будет интересно:Каково значение слова "сострадание"?
Вам будет интересно:Каково значение слова "сострадание"?
Существует две различные теории, которые часто используют для описания газового состояния вещества: молекулярно-кинетическая (МКТ) и термодинамика. МКТ использует свойства идеального газа, статистическое распределение частиц по скоростям, а также связь кинетической энергии и количества движения с температурой, чтобы рассчитывать макроскопические характеристики системы. В свою очередь, термодинамика не вникает в микроскопическое строение газов, она рассматривает систему, как единое целое, описывая ее макроскопическими термодинамическими параметрами.
Термодинамические параметры идеальных газов
Существует три основных параметра для описания идеальных газов и одна дополнительная макроскопическая характеристика. Перечислим их:
Далее в статье будет приведена формула уравнения Клапейрона, в которой присутствуют все четыре описанных характеристики идеального газа.
Универсальное уравнение состояния
Уравнение состояния идеального газа Клапейрона принято записывать в следующей форме:
P*V = n*R*T
Равенство показывает, что произведение давления на объем должно быть пропорционально произведению температуры на количество вещества для любого идеального газа. Величина R называется универсальной газовой постоянной и одновременно коэффициентом пропорциональности между основными макроскопическими характеристиками системы.
Следует отметить важную особенность этого уравнения: оно не зависит от химической природы и состава газа. Именно поэтому его часто называют универсальным.

Впервые это равенство было получено в 1834 году французским физиком и инженером Эмилем Клапейроном в результате обобщения экспериментальных законов Бойля-Мариотта, Шарля и Гей-Люссака. Однако Клапейрон использовал несколько неудобную систему констант. Впоследствии все константы Клапейрона были заменены на одну единственную величину R. Сделал это Дмитрий Иванович Менделеев, поэтому записанное выражение также называют формулой уравнения Клапейрона-Менделеева.
Другие формы записи уравнения
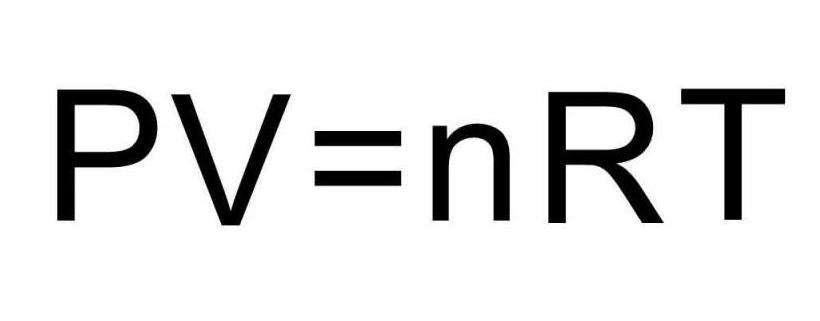
В предыдущем пункте была приведена основная форма записи уравнения Клапейрона. Тем не менее в задачах по физике часто вместо количества вещества и объема могут быть заданы другие величины, поэтому будет полезным привести иные формы записи универсального уравнения для идеального газа.
Из теории МКТ следует такое равенство:
P*V = N*kB*T.
Это тоже уравнение состояния, только в нем появляется менее удобная в использовании величина N (число частиц), чем количество вещества n. Также нет универсальной газовой постоянной. Вместо нее используется постоянная Больцмана. Записанное равенство легко преобразуется в универсальную форму, если принять во внимание следующие выражения:
n = N/NA;
R = NA*kB.
Здесь NA - число Авогадро.
Еще одной полезной формой уравнения состояния является следующая:
P*V = m/M*R*T
Здесь отношение массы m газа к молярной массе M по определению является количеством вещества n.
Наконец, еще одно полезное выражение для идеального газа - это формула, которая использует понятие его плотности ρ:
P = ρ*R*T/M
Решение задачи
Водород находится в баллоне объемом 150 литров под давлением 2 атмосферы. Необходимо вычислить плотность газа, если известно, что температура баллона составляет 300 К.
Прежде чем начинать решение задачи, переведем единицы измерения давления и объема в СИ:
P = 2 атм. = 2*101325 = 202650 Па;
V = 150*10-3 = 0,15 м3.
Для вычисления плотности водорода воспользуемся следующим уравнением:
P = ρ*R*T/M.
Из него получаем:
ρ = M*P/(R*T).
Молярную массу водорода можно посмотреть в периодической таблице Менделеева. Она равна 2*10-3 кг/моль. Величина R равна 8,314 Дж/(моль*К). Подставляя эти значения и величины давления, температуры и объема из условия задачи, получим следующую плотность водорода в баллоне:
ρ = 2*10-3*202650/(8,314*300) = 0,162 кг/м3.
Для сравнения отметим, плотность воздуха составляет приблизительно 1,225 кг/м3 при давлении 1 атмосфера. Водород является менее плотным, так как его молярная масса значительно меньше таковой для воздуха (в 15 раз).

