Газы, с точки зрения термодинамики, описываются набором макроскопических характеристик, главными из которых являются температура, давление и объем. Постоянство одного из названных параметров и изменение двух других говорит о том, что в газе протекает тот или иной изопроцесс. Эту статью посвятим подробному ответу на вопросы, что это - изохорный процесс, чем он отличается от изотермического и изобарного изменения состояний газовой системы.
Идеальный газ в физике

 Вам будет интересно:Северная Буковина: географическое положение, история, описание
Вам будет интересно:Северная Буковина: географическое положение, история, описание
Прежде чем отвечать на вопрос, что это - изохорный процесс, следует познакомиться поближе с понятием идеального газа. В физике под ним понимают любой газ, у которого средняя кинетическая энергия составляющих его частиц намного превышает энергию потенциальную их взаимодействия, и расстояния между этими частицами на несколько порядков больше их линейных размеров. При отмеченных условиях можно при проведении расчетов не учитывать энергию взаимодействия между частицами (она равной нулю), а также можно полагать, что частицы являются материальными точками, имеющими некоторую массу m.
Единственным процессом, который имеет место в идеальном газе, являются соударения частиц со стенками сосуда, в котором находится субстанция. Эти соударения на практике проявляются в виде существования в газе некоторого давления P.
 Вам будет интересно:Реформы Алексея Михайловича Романова. Правление Алексея Михайловича
Вам будет интересно:Реформы Алексея Михайловича Романова. Правление Алексея Михайловича
Как правило, любая газовая субстанция, которая состоит из относительно химически инертных молекул и которая имеет небольшое давление и высокие температуры, может считаться газом идеальным с достаточной для проведения практических расчетов точностью.
Описывающее идеальный газ уравнение
Конечно же, речь идет об универсальном законе Клапейрона-Менделеева, с которым следует хорошо разобраться, чтобы понять, что это - изохорный процесс. Итак, универсальное уравнение состояния имеет следующую форму:
P * V = n * R * T.
То есть произведение давления P на объем газа V равен произведению температуры абсолютной T на количество вещества в молях n, где величина R является коэффициентом пропорциональности. Само уравнение было записано впервые Эмилем Клапейроном в 1834 году, а в 70-е годы XIX века Д. Менделеев заменил в нем набор постоянных величин одной единственной универсальной газовой постоянной R (8,314 Дж/(моль*К)).
В соответствии с уравнением Клапейрона-Менделеева, в закрытой системе количество частиц газа остается постоянным, поэтому существует всего три макроскопических параметра, которые могут изменяться (T, P и V). Последний факт лежит в основе понимания различных изопроцессов, которые будут рассмотрены ниже.
Что это - изохорный процесс?
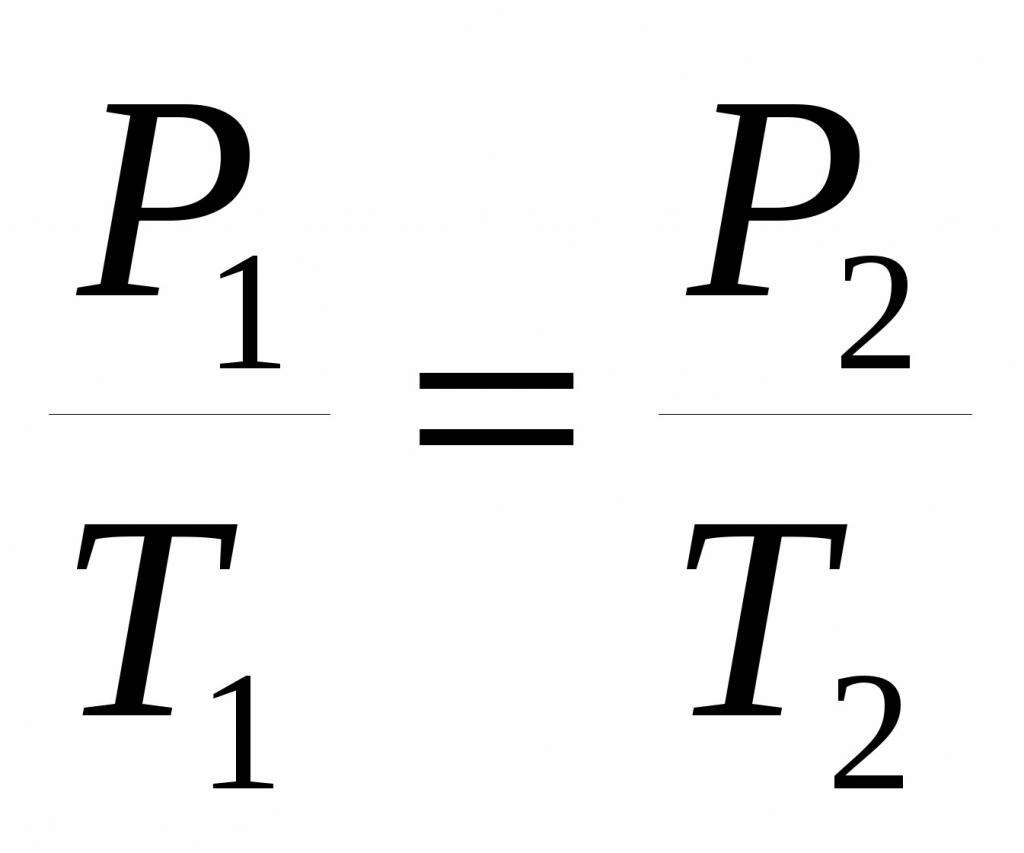
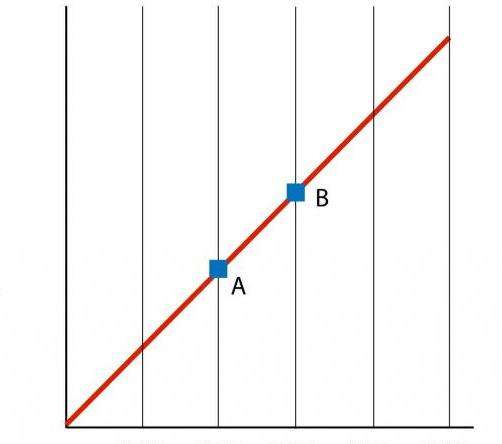
Под этим процессом понимают абсолютно любое изменение состояния системы, при котором ее объем сохраняется.
Если обратиться к универсальному уравнению состояния, то можно сказать, что при изохорном процессе в газе изменяются только давление и абсолютная температура. Чтобы понять, как именно происходит изменение термодинамических параметров, запишем соответствующее математическое выражение:
P / T = const.
Иногда это равенство приводят в несколько иной форме:
P1 / T1 = P2 / T2.
Оба равенства называются законом Шарля по фамилии французского ученого, который в конце XVIII века получил отмеченную зависимость экспериментальным путем.

Если построить график функции P(T), то мы получим прямолинейную зависимость, которая называется изохорой. Любая изохора (для всех значений n и V) является прямой линией.
Энергетическое описание процесса
Как было отмечено, изохорный процесс - это изменение состояния системы, которое проходит в закрытой, но не изолированной системе. Речь идет о возможности обмена теплом между газом и окружающей средой. В общем случае любой подвод теплоты Q к системе приводит к двум результатам:
- изменяется внутренняя энергия U;
- газ совершает работу A, расширяясь или сжимаясь.
Последнее умозаключение записывается математически следующим образом:
Q = U + A.
Изохорный процесс идеального газа по своему определению не предполагает совершение газом работы, так как его объем остается неизменным. Это означает, что все подводимое к системе тепло идет на увеличение его внутренней энергии:
Q = U.
Если подставить в это выражение явную формулу для внутренней энергии, то теплоту изохорного процесса можно представить в виде:
Q = z / 2 * n * R * T.
Здесь z - число степеней свободы, которое определяется многоатомностью составляющих газ молекул. Для одноатомного газа z = 3, для двухатомного - 5, а для трехатомного и более - 6. Здесь под степенями свободы имеются в виду поступательные и вращательные степени.
Если сравнивать эффективность нагрева газовой системы при изохорном и изобарном процессах, то в первом случае мы получим максимальный КПД, поскольку во время изобарного изменения состояния системы газ расширяется, и часть подводимого тепла расходуется на выполнение работы.
Изобарный процесс
Выше мы подробно охарактеризовали, что это - изохорный процесс. Теперь скажем несколько слов о других изопроцессах. Начнем с изобарного. Исходя из названия, под ним понимают переход системы между состояниями при постоянном давлении. Этот процесс описывается законом Гей-Люссака в следующем виде:
V / T = const.
Как и в случае изохоры, изобара V(T) также представляет прямую линию на графике.
Для любого изобарного процесса удобно рассчитывать совершаемую газом работу, так как она равна произведению постоянного давления на величину изменения объема.
Изотермический процесс
Это процесс, при котором температура системы остается постоянной. Описывается он законом Бойля-Мариотта для идеального газа. Любопытно отметить, что это первый открытый экспериментально газовый закон (вторая половина XVII века). Его математическая запись выглядит так:
P * V = const.
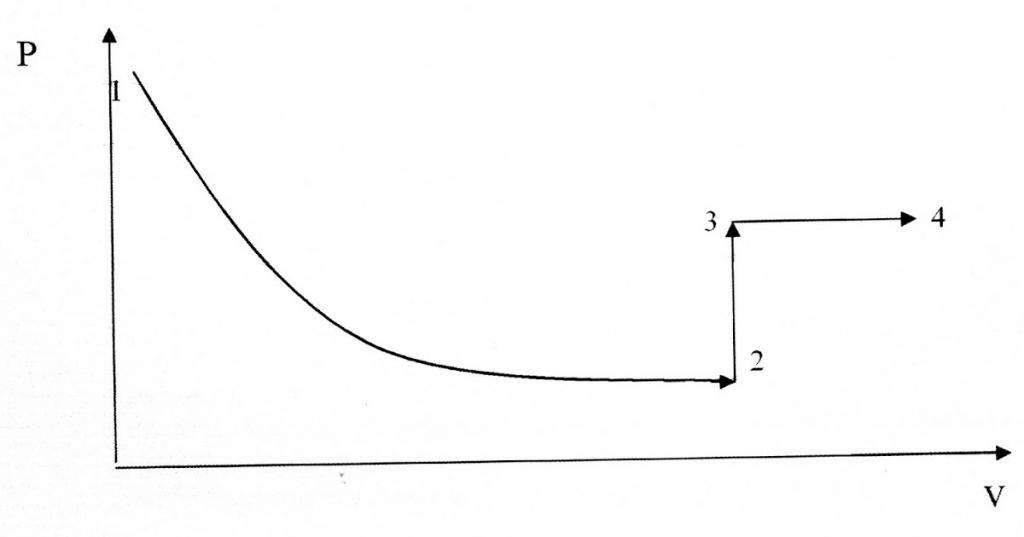
Изохорный и изотермический процессы отличаются в плане их графического представления, поскольку функция P(V) представляет собой гиперболическую, а не линейную зависимость.
Пример решения задачи
Закрепим предоставленные в статье теоретические сведения их применением для решения практической проблемы. Известно, что чистый газообразный азот находился в баллоне при давлении 1 атмосфера и температуре 25 °C. После того как баллон с газом нагрели и измерили давление в нем, оно оказалось равным 1,5 атмосферы. Чему равна температура газа в баллоне после нагрева? На какую величину изменилась внутренняя энергия газа, если в баллоне находилось 4 моль азота.
Для ответа на первый вопрос воспользуемся следующим выражением:
P1 / T1 = P2 / T2.
Откуда получаем:
T2 = P2 / P1 * T1.
В этом выражении давления можно подставлять в произвольных единицах измерения, так как они сокращаются, а температуру только в кельвинах. С учетом сказанного получаем:
T2 = 1,5 /1 * 298,15 = 447,224 К.
Рассчитанная температура в градусах Цельсия равна 174 °C.
Поскольку молекула азота является двухатомной, то изменение внутренней его энергии при нагреве можно определить так:
ΔU = 5 / 2 * n * R * ΔT.
Подставляя известные величины в это выражение, мы получим ответ на второй вопрос задачи: ΔU = +12,4 кДж.