Важным разделом физики является термодинамика. Она изучает различные переходы между состояниями системы. Проще всего с математической точки зрения исследовать процессы, в которых один из термодинамических параметров является фиксированным. В данной статье подробно рассмотрим вопрос, что это - изотермический процесс.
Термодинамическая система
Системой в термодинамике принято называть некоторую совокупность составляющих ее элементов, которые могут обмениваться между собой энергией. Как правило, этими элементами являются атомы и молекулы. Система находится в термодинамическом равновесии, когда все ее макроскопические характеристики не меняются во времени.
 Вам будет интересно:Организационные инновации: характеристика, формы инноваций, цели
Вам будет интересно:Организационные инновации: характеристика, формы инноваций, цели
Системы бывают открытые, закрытые и изолированные. В открытых происходит обмен энергией и веществом с внешней средой, в закрытых системах возможен только обмен энергией с окружающей средой. Наконец, изолированные системы полностью предоставлены самим себе. Их энергия и количество вещества сохраняются с течением времени.
Отметим, что понятие термодинамической системы не связано с агрегатным состоянием материи. Так, вода и водяной пар в закрытом сосуде или лед, плавающий в стакане с водой, являются примерами термодинамических систем, в которых в равновесии одновременно находятся два агрегатных состояния одного и того же химического вещества.
Термодинамические параметры
 Вам будет интересно:Основные этапы конституционного развития России: общая характеристика
Вам будет интересно:Основные этапы конституционного развития России: общая характеристика
Чтобы иметь возможность описывать состояние термодинамической системы и его изменение, в физике используют такие параметры, как давление P, температуру T и объем V. Все они являются экспериментально измеряемыми величинами. Так, давление определяют барометром (единица измерения - паскали), температуру - термометром (единица измерения - кельвины), объем определяют, исходя из формы и линейных размеров объекта (единица измерения - кубические метры).

Рассматриваемые величины (P, T, V) человечество измеряло с давних времен, пользуясь различными эмпирическими методами и методами сравнения (горячее - холодное, большое-маленькое). Лишь с приходом Нового времени многие ученые Европы стали подходить к вопросу измерения макроскопических параметров с научной точки зрения. Развитие в XVIII-XIX веках молекулярно-кинетической теории газов и жидкостей позволило связать макроскопические термодинамические характеристики с микроскопическими параметрами системы.
Что это - изотермический процесс?
Теперь пришло время ответить на основной вопрос статьи. Ответить на вопрос, что это - изотермический процесс, не представляет большой сложности. Так называют любой переход между двумя состояниями системы, при котором абсолютная температура остается постоянной и не изменяется. Например, если медленно увеличивать объем газа в цилиндре с помощью перемещения поршня, то такой тепловой процесс будет изотермическим (тепловой обмен с окружающей средой при медленном расширении газа будет поддерживать постоянной его температуру).
Приведенный выше пример не является единственным. Рассматривая, что это - изотермический процесс, следует отметить следующие важные примеры, которые описывают изменение состояния системы при постоянной температуре:
- изотермическое расширение и сжатие идеального газа;
- смешение идеальных газов при постоянной температуре;
- переходы между агрегатными состояниями.
Рассмотрим каждый из них подробнее в статье.
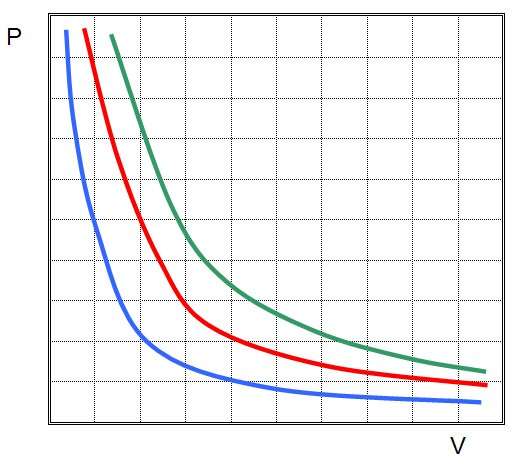
Закон Бойля-Мариотта
Во второй половине XVII века англичанин Роберт Бойль и француз Эдм Мариотт независимо друг от друга экспериментально установили следующее отношение для газовых систем:
P*V = const.
В экспериментах они использовали разные газы. При этом произведение давления на объем всегда оставалось постоянным. Это уравнение называется законом Бойля-Мариотта. Графически функция P(V) представляет собой гиперболическую зависимость.
Мы только что рассмотрели изотермический процесс в идеальном газе. Понять выражение выше несложно, если вспомнить, как выглядит универсальное уравнение состояния для газовой системы:
P*V = n*R*T
Так как T=const, n - это количество вещества, которое также не изменяется, поскольку система является закрытой, R - универсальная газовая постоянная, то правая часть универсального уравнения для рассматриваемого процесса является постоянной, а значит, левая часть также не изменяется.
Принцип Авогадро
В 1810 году, экспериментируя с разными газами, Амедео Авогадро пришел к удивительному выводу. Оказалось, что занимаемый газом объем является функцией только количества вещества при определенном давлении и температуре. Не важно, из каких молекул и атомов состоит газовая система, 1 моль любого газа всегда занимает один и тот же объем, если P=const и T=const.
Понять изложенный принцип не сложно, если обратиться снова к универсальному уравнению для идеального газа. Имеем:
V/n = R*T/P = const при P=const, T=const
Рассмотренный процесс является изобарно-изотермическим.
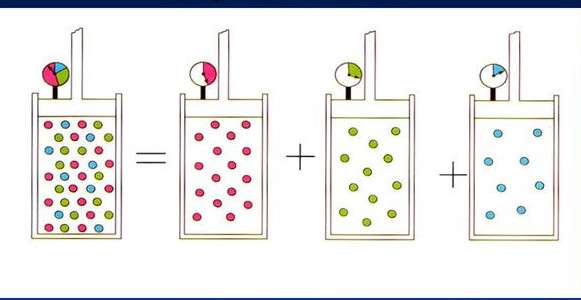
Принцип Авогадро положен в основу закона Дальтона. Если проводить смешение двух идеальных газов при постоянной температуре в сосуде с некоторым фиксированным объемом, то абсолютное давление в системе будет равно сумме парциальных давлений каждого компонента. В свою очередь парциальное давление компонента прямо пропорционально атомной доле его частиц в смеси:
P = ∑i=1m(Pi) = R*T/V*∑i=1m(ni)
Здесь m - количество компонент в смеси. Процесс смешивания газов является изохорно-изотермическим.
Переход между агрегатными состояниями вещества
Речь идет о процессах плавления твердого тела или кристаллизации жидкости, о процессах кипения жидкости или конденсации газа. Все эти переходы происходят либо с выделением, либо с поглощением тепла. Так, в результате кристаллизации молекулы жидкости теряют энергию, выделяя ее в окружающую среду. Последнее приводит к уменьшению кинетической энергии молекул и формированию из них определенной структуры (аморфной, кристаллической). Наоборот, плавление является эндотермическим процессом, то есть он идет с поглощением теплоты. Эта теплота расходуется на разрушение химических связей между молекулами и атомами в твердом теле.
Любой переход между агрегатными состояниями материи - это изотермический процесс, то есть он осуществляется при постоянной температуре. Например, всем известно, что чистый лед плавится при 0 oC, но при 0 oC также происходит кристаллизация воды.
Определение теплового эффекта перехода между агрегатными состояниями

Все термодинамические расчеты процессов кристаллизации, плавления, конденсации и кипения проводятся с использованием следующей формулы:
Q = λ*m
Здесь Q - количество теплоты, которое выделяется или поглощается в результате превращения m килограмм вещества из одного агрегатного состояния в другое. Величина λ - это константа теплового процесса, название которой зависит от конкретного превращения. Например, в случае плавления она называется удельной теплотой плавления. Измеряется λ в Дж/кг.