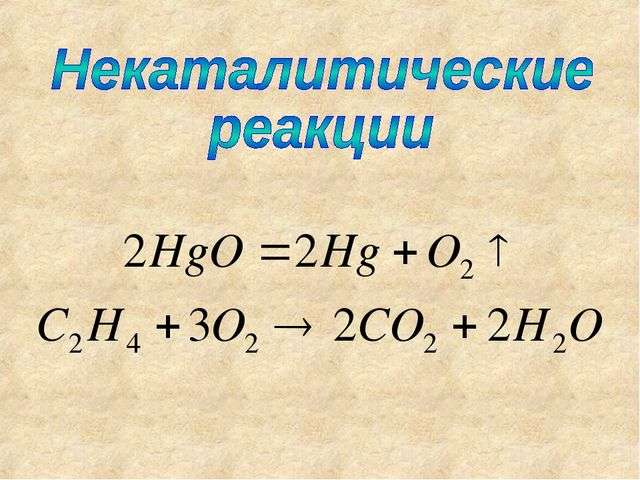В связи с бурным ростом промышленности, каталитические реакции становятся все более востребованными в химическом производстве, машиностроении, металлургии. Благодаря применению катализаторов удается сырье низкого сорта превратить в ценный продукт.
Значимость
Каталитические реакции отличаются многообразием используемых агентов. В органическом синтезе они способствуют существенному ускорению дегидрирования, гидрирования, гидратации, окисления, полимеризации. Катализатор можно считать «философским камнем», который превращает исходное сырье в готовые продукты: волокна, лекарственные препараты, химические вещества, удобрения, топливо, пластмассы.
 Вам будет интересно:Непроизвольно – это случайное внимание или машинальный рефлекс? И то, и другое!
Вам будет интересно:Непроизвольно – это случайное внимание или машинальный рефлекс? И то, и другое!
Каталитические реакции позволяют получать многочисленные продукты, без которых невозможна нормальная жизнь и деятельность человека.
Катализ позволяет ускорять процессы в тысячи и миллионы раз, поэтому он используется в настоящее время в 91 % разнообразных химических производств.
Интересные факты
 Вам будет интересно:Список преподавателей: образовательная информация, квалификация, отзывы
Вам будет интересно:Список преподавателей: образовательная информация, квалификация, отзывы
Многие современные промышленные процессы, к примеру, синтез серной кислоты, осуществимы только при условии использования катализатора. Большое многообразие каталитических агентов обеспечивает создание моторных масел для автомобильной промышленности. В 1900 году впервые в промышленных масштабах был проведен каталитический синтез маргарина из растительного сырья (путем гидрирования).
С 1920 года был разработан механизм каталитических реакций получения волокон и пластмасс. Знаковым событием стало каталитическое получение эфиров, олефинов, карбоновых кислот, а также иных исходных веществ для изготовления полимерных соединений.
Переработка нефти
С середины прошлого века каталитические реакции стали применяться в переработке нефти. Переработка этого ценного природного ископаемого предполагает сразу несколько каталитических процессов:
-
риформинг;
-
крекинг;
-
гидросульфирование;
-
полимеризация;
-
гидрокрекинг;
-
алкилирование.
С конца прошлого века удалось разработать каталитический нейтрализатор, позволяющий снижать выбросы выхлопных газов в атмосферу.
За работы, касающиеся катализа и смежных областей, было вручено несколько Нобелевских премий.
Практическая значимость
Каталитической реакцией является любой процесс, который предполагает использование ускорителей (катализаторов). Для оценки практической значимости подобных взаимодействий можно привести в качестве примера реакции, связанные с азотом и его соединениями. Так как в природе это количество весьма ограничено, создание пищевого белка без применения синтетического аммиака весьма проблематично. Проблема была решена с разработкой каталитического процесса Габера-Боша. Постоянно расширяется область использования катализаторов, что позволяет увеличивать эффективность многих технологий.
Производство аммиака
Рассмотрим некоторые каталитические реакции. Примеры из неорганической химии приведем на основе самых распространенных производств. Синтез аммиака — это экзотермическая, обратимая реакция, которая характеризуется уменьшением объема газообразного вещества. Протекает процесс на катализаторе, в качестве которого выступает пористое железо с добавлением оксида алюминия, кальция, калия, кремния. Такой катализатор активен и устойчив в диапазоне температур 650-830К.
Необратимо отправляют его соединения серы, в частности, угарный газ (СО). На протяжении нескольких последних десятилетий благодаря внедрению инновационных технологий удалось существенно снизить давление. К примеру, был изготовлен конвертор, позволяющий понизить показатель давления до 8*106 — 15*106 Па .
Модернизация фронтального контура существенно снизила вероятность нахождения в нем каталитических ядов — соединений серы, хлора. Существенно возросли и требования к катализатору. Если ранее его производили путем плавления оксидов железа (окалины), добавляя окислы магния и кальция, то в настоящее время роль нового активатора выполняет оксид кобальта.
Окисление аммиака

Чем характеризуются каталитические и некаталитические реакции? Примеры процессов, протекание которых зависит от добавления определенных веществ, можно рассмотреть на основе окисления аммиака:
4NH3+ 5O2= 4NO+ 6H2O.
Данный процесс возможен при температуре порядка 800°C, а также селективном катализаторе. Для ускорения взаимодействия применяют платину и ее сплавы с марганцем, железом, хромом, кобальтом. В настоящее время главным промышленным катализатором является смесь платины с родием и палладием. Подобный подход позволил существенно удешевить процесс.
Разложение воды
Рассматривая уравнения каталитических реакций, нельзя оставить без должного внимания и реакцию получения газообразного кислорода и водорода путем электролиза воды. Процесс предполагает существенные энергозатраты, поэтому в промышленных масштабах он используется нечасто.
В качестве оптимального ускорителя для подобного процесса выступает металлическая платина при размерах частиц порядка 5-10 нм (нанокластеров). Введение такого вещества способствует ускорению разложения воды на 20-30 процентов. Среди преимуществ также можно отметить и устойчивость платинового катализатора угарным газом.
В 2010 году команда американских ученых получила дешевый катализатор, позволяющий снижать энергозатраты для протекания электролиза воды. Им стало соединение никеля и бора, стоимость которого существенно ниже платины. Бор-никелевый катализатор был по достоинству оценен в производстве промышленного водорода.
Синтез йодида алюминия
Получают эту соль путем взаимодействия порошка алюминия с йодом. Достаточно одной капли воды, играющей роль катализатора, чтобы началось химическое взаимодействие.
Сначала роль ускорителя процесса выполняет оксидная пленка алюминия. Йод, растворяясь в воде, образует смесь йодоводородной и йодноватистой кислот. Кислота, в свою очередь, растворяет оксидную пленку алюминия, выполняя роль катализатора химического процесса.
Подведем итоги
С каждым годом возрастают масштабы применения каталитических процессов в разнообразных областях современной промышленности. Востребованы катализаторы, которые позволяют нейтрализовать вещества, опасные для окружающей среды. Растет и роль соединений, необходимых для изготовления синтетических углеводородов из угля и газа. Новые технологии способствуют снижению энергетических затрат при промышленных производствах разнообразных веществ.
Благодаря катализу можно получать полимерные соединения, продукты с ценными свойствами, модернизировать технологии преобразования топлива в электрическую энергию, синтезировать вещества, необходимые для жизни и деятельности человека.