Окружающие нас природные явления и процессы являются достаточно сложными. Для их точного физического описания следует применять громоздкий математический аппарат и учитывать большое количество значимых факторов. Чтобы избежать этой проблемы, в физике используют некоторые упрощенные модели, которые значительно облегчают математический анализ процесса, но практически не влияют на точность его описания. Одной из них является модель идеального газа. Рассмотрим ее в статье подробнее.
Понятие о газе идеальном
 Вам будет интересно:Какова твердость соли по шкале твердости Мооса?
Вам будет интересно:Какова твердость соли по шкале твердости Мооса?
Идеальный газ - это агрегатное состояние вещества, которое состоит из не взаимодействующих друг с другом материальных точек. Поясним подробнее подобное определение.
Во-первых, речь идет о материальных точках как объектах, составляющих идеальный газ. Это означает, что его молекулы и атомы не обладают размером, но имеют определенную массу. Это смелое приближение можно сделать с учетом того, что во всех реальных газах при невысоких показателях давления и больших температурах расстояние между молекулами намного превышает их линейные размеры.
Во-вторых, молекулы в идеальном газе должны не взаимодействовать друг с другом. В действительности такие взаимодействия всегда существуют. Так, даже атомы благородных газов испытывают диполь-дипольное притяжение. Иными словами, присутствуют ван-дер-ваальсовые взаимодействия. Тем не менее по сравнению с кинетической энергией вращения и поступательного перемещения молекул эти взаимодействия настолько незначительны, что они не влияют на свойства газов. Поэтому их можно не рассматривать при решении практических задач.
Важно отметить, что не все газы, плотность в которых невелика, а температура высока, могут считаться идеальными. Помимо ван-дер-ваальсовых взаимодействий существуют другие, более сильные типы связей, например, водородные между молекулами H2O, которые приводят к грубому нарушению условий идеальности газа. По этой причине водяной пар не является идеальным газом, а воздух является им.
Физическая модель идеального газа
Эту модель можно представить следующим образом: предположим, что газовая система содержит N частиц. Это могут быть атомы и молекулы различных химических веществ и элементов. Количество частиц N велико, поэтому для его описания обычно используют единицу "моль" (1 моль соответствует числу Авогадро). Все они движутся в некотором объеме V. Движения частиц являются хаотичными и независимыми друг от друга. Каждая из них обладает определенной скоростью v и перемещается по прямой траектории.
Теоретически вероятность столкновения между частицами практически равна нулю, поскольку их размер невелик по сравнению с межчастичными расстояниями. Однако если такое столкновение происходит, то оно является абсолютно упругим. В последнем случае суммарный импульс частиц и их кинетическая энергия сохраняются.
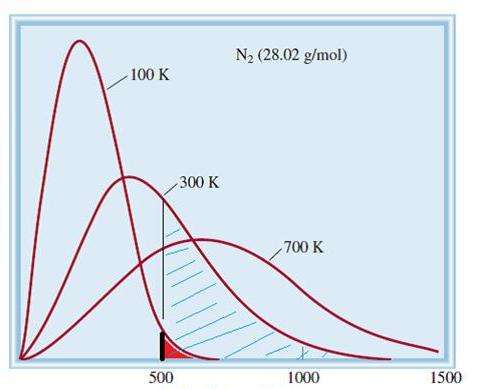
Рассмотренная модель идеальных газов является классической системой с огромным числом элементов. Поэтому скорости и энергия частиц в ней подчиняются статистическому распределению Максвелла-Больцмана. Одни частицы имеют малые скорости, другие - большие. При этом существует некоторый узкий предел скоростей, в котором лежат наиболее вероятные значения этой величины. График распределения молекул азота по скоростям схематически показан ниже.
Кинетическая теория газов
Описанная выше модель идеальных газов свойства газов определяет однозначно. Впервые эта модель была предложена Даниилом Бернулли в 1738 году.

Впоследствии ее развили до современного состояния Август Крениг, Рудольф Клаузиус, Михаил Ломоносов, Джеймс Максвелл, Людвиг Больцман, Мариан Смолуховский и другие ученые.
Кинетическая теория текучих субстанций, на основании которой построена модель идеального газа, объясняет два важных макроскопических свойства системы на основании ее микроскопического поведения:
- Давление в газах является результатом столкновения частиц со стенками сосуда.
- Температура в системе - это результат проявления постоянного движения молекул и атомов.
Раскроем подробнее оба вывода кинетической теории.
Давление газа
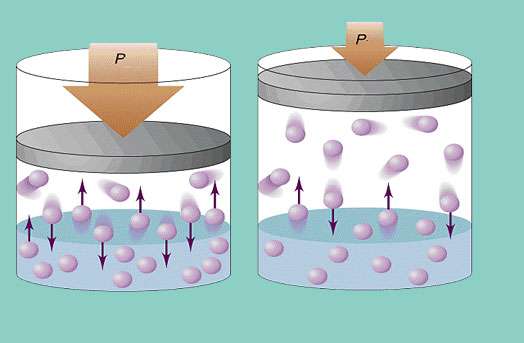
Модель идеального газа предполагает постоянное хаотичное перемещение частиц в системе и их постоянное соударение со стенками сосуда. Каждое такое соударение считается абсолютно упругим. Масса частицы невелика (≈10-27-10-25 кг). Поэтому создать большое давление при столкновении она не может. Тем не менее количество частиц, а значит, и столкновений огромно (≈1023). Кроме того, средняя квадратичная скорость элементов составляет несколько сотен метров в секунду при комнатной температуре. Все это приводит к созданию на стенки сосуда ощутимого давления. Его можно вычислить по такой формуле:
P = N * m * vcp2 / (3 * V),
где vcp - средняя квадратичная скорость, m - масса частицы.
Абсолютная температура
Согласно модели идеального газа, температура однозначно определяется средней кинетической энергией молекулы или атома в изучаемой системе. Можно записать следующее выражение, которое связывает кинетическую энергию и абсолютную температуру для идеального газа:
m * vcp2 / 2 = 3 / 2 * kB * T.
Здесь kB - константа Больцмана. Из этого равенства получаем:
T = m * vcp2 / (3 * kB).
Универсальное уравнение состояния
Если объединить записанные выше выражения для абсолютного давления P и абсолютной температуры T, то можно записать следующее равенство:
P * V = n * R * T.
Здесь n - это количество вещества в молях, R - газовая константа, введенная Д. И. Менделеевым. Это выражение является самым важным уравнением теории идеальных газов, поскольку оно объединяет три термодинамических параметра (V, P, T) и не зависит от химических особенностей газовой системы.

Универсальное уравнение впервые было выведено экспериментальным путем французским физиком Эмилем Клапейроном в XIX веке, а затем приведено к современной форме русским химиком Менделеевым, поэтому в настоящее время оно носит фамилии этих ученых.