Термодинамика - это важный раздел физики, который изучает и описывает находящиеся в равновесии или стремящиеся к нему термодинамические системы. Чтобы с помощью уравнений термодинамики можно было описать переход из некоторого начального состояния в конечное, необходимо сделать приближение квазистатического процесса. В чем заключается это приближение, и какие виды этих процессов бывают, рассмотрим в данной статье.
Что понимают под квазистатическим процессом?
Как известно, термодинамика для описания состояния системы использует набор макроскопических характеристик, которые можно измерить экспериментально. К ним относятся давление P, объем V и абсолютная температура T. Если все три величины в данный момент для изучаемой системы известны, то говорят о том, что ее состояние определено.
 Вам будет интересно:Задачи социологии: предметы, основные методы, цели и развитие
Вам будет интересно:Задачи социологии: предметы, основные методы, цели и развитие
Понятие квазистатического процесса предполагает наличие перехода между двумя состояниями. В процессе такого перехода, естественно, термодинамические характеристики системы изменяются. Если в каждый момент времени, в процессе которого продолжается переход, T, P и V известны для системы, и она находится недалеко от своего равновесного состояния, то говорят о том, что происходит квазистатический процесс. Иными словами, указанный процесс представляет собой последовательный переход между множеством равновесных состояний. Он предполагает, что внешнее воздействие на систему является незначительным, чтобы она успевала быстро приходить к равновесию.
Реальные процессы не являются квазистатическими, поэтому рассматриваемое понятие будет идеализированным. Например, при расширении или сжатии газа существуют турбулентные изменения и волновые процессы в нем, которые предполагают некоторое время для их затухания. Тем не менее в ряде практических случаев для газов, частицы в которых движутся с большими скоростями, равновесие наступает быстро, поэтому различные переходы между состояниями в них можно считать с высокой точностью квазистатическими.
Уравнение состояния и виды процессов в газах
Газ является удобным агрегатным состоянием вещества для его изучения в термодинамике. Связано это с тем, что для его описания существует простое уравнение, связывающее все три упомянутых выше термодинамических величины. Это уравнение называется законом Клапейрона-Менделеева. Оно имеет следующий вид:
P*V = n*R*T
С использованием этого уравнения изучаются все виды изопроцессов и адиабатический переход и строятся графики изобары, изотермы, изохоры и адиабаты. В равенстве n - это количество вещества в системе, R - постоянная для всех газов. Ниже рассмотрим все отмеченные виды квазистатических процессов.
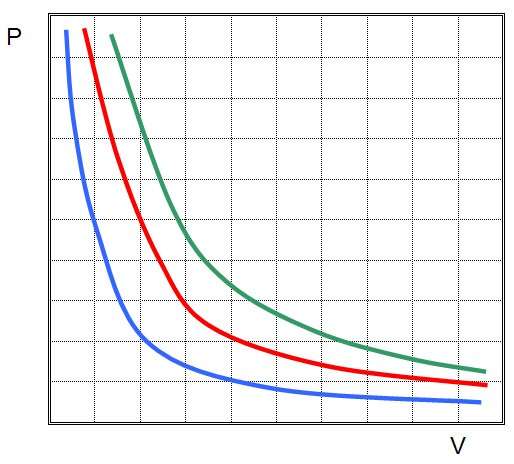
Изотермический переход
Он впервые был изучен в конце XVII века на примере различных газов. Соответствующие эксперименты были поставлены Робертом Бойлем и Эдмом Мариоттом. Ученые пришли к следующему результату:
P*V = const при T = const
Если увеличивать давление в системе, то ее объем будет уменьшаться пропорционально этому увеличению, если в системе поддерживается постоянной температура. Несложно получить этот закон из уравнения состояния самостоятельно.
Изотерма на графике представляет собой гиперболу, которая приближается к осям P и V.
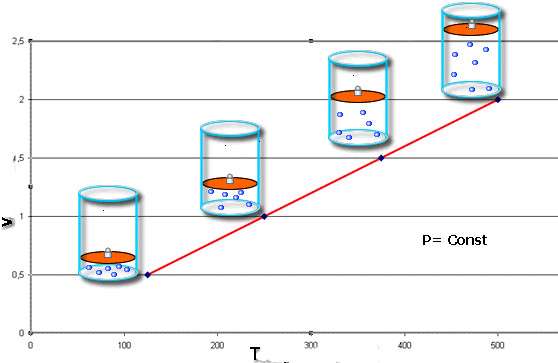
Изобарный и изохорный переходы
Изобарный (при постоянном давлении) и изохорный (при неизменном объеме) переходы в газах были изучены в начале XIX века. Большие заслуги в их изучении и открытии соответствующих законов принадлежат французам Жаку Шарлю и Гей-Люссаку. Оба процесса математически представляются следующим образом:
V/T = const при P = const;
P/T = const при V = const
Оба выражения следуют из уравнения состояния, если положить соответствующий параметр постоянным.
Мы объединили эти переходы в рамках одного пункта статьи потому, что они имеют одинаковое графическое представление. В отличие от изотермы, изобара и изохора - это прямые линии, которые показывают прямую пропорциональность между объемом и температурой и давлением и температурой соответственно.
Процесс адиабатический
Он отличается от описанных изопроцессов тем, что протекает в полной тепловой изоляции от окружающей среды. В результате адиабатического перехода газ расширяется или сжимается без обмена теплом с внешней средой. При этом происходит соответствующее изменение его внутренней энергии, то есть:
dU = - P*dV
Для описания адиабатического квазистатического процесса важно знать две величины: изобарную CP и изохорную CV теплоемкости. Величина CP говорит о том, сколько теплоты следует сообщить системе, чтобы она увеличила свою температуру на 1 К при изобарном расширении. Величина CV означает то же самое, только для нагрева при постоянном объеме.
Уравнение этого процесса для идеального газа называется уравнением Пуассона. Оно в параметрах P и V записывается так:
P*Vγ = const
Здесь параметр γ называется показателем адиабаты. Он равен отношению величин CP и CV. Для одноатомного газа γ=1,67, для двухатомного - 1,4, если газ образован более сложными молекулами, то γ=1,33.
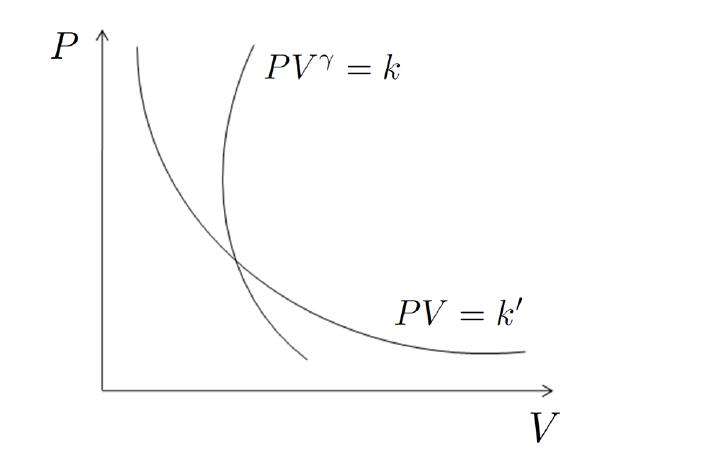
Поскольку адиабатический процесс происходит исключительно за счет собственных внутренних энергетических ресурсов, то график адиабаты в осях P-V ведет себя более резко, чем график изотермы (гипербола).