В 1924 году молодой французский физик-теоретик Луи де Бройль ввел в научный оборот понятие о волнах материи. Это смелое теоретическое предположение распространило свойство корпускулярно-волнового дуализма (двойственности) на все проявления материи – не только на излучение, но и на любые частицы вещества. И хотя современная квантовая теория понимает «волну материи» иначе, нежели автор гипотезы, этот физический феномен, связанный с вещественными частицами, носит его имя – волна де Бройля.
История рождения понятия
 Вам будет интересно:Полное внутреннее отражение света: описание, условия и законы
Вам будет интересно:Полное внутреннее отражение света: описание, условия и законы
Предложенная в 1913 году Н. Бором полуклассическая модель атома была основана на двух постулатах:
 Вам будет интересно:Формула подъемной силы. Почему самолеты летают? Законы аэродинамики
Вам будет интересно:Формула подъемной силы. Почему самолеты летают? Законы аэродинамики
Итак, боровская модель атома «запретила» электрону излучать на орбите и находиться между орбитами, однако движение его рассматривала классически, подобно обращению планеты вокруг Солнца. Де Бройль искал ответ на вопрос, почему электрон ведет себя именно так. Нельзя ли естественным образом объяснить наличие допустимых орбит? Он предположил, что электрону обязательно должна сопутствовать некоторая волна. Именно ее присутствие заставляет частицу «выбирать» только такие орбиты, на которых эта волна укладывается целое число раз. В этом и заключался смысл целочисленного коэффициента в постулированной Бором формуле.

Из гипотезы следовало, что, электронная волна де Бройля – не электромагнитная, и волновые параметры должны быть свойственны любым частицам материи, а не только электронам в атоме.
Расчет длины волны, связанной с частицей
 Вам будет интересно:Аномалии воды и их характеристика
Вам будет интересно:Аномалии воды и их характеристика
Молодой ученый получил чрезвычайно интересное соотношение, позволяющее определить, каковы же эти волновые свойства. Что представляет собой в количественном отношении волна де Бройля? Формула для ее расчета имеет простой вид: λ = h/p. Здесь λ – длина волны, а p – импульс частицы. Для нерелятивистских частиц данное отношение можно записать как λ = h/mv, где m – масса, а v – скорость частицы.
Почему эта формула представляет особый интерес, видно из величин, стоящих в ней. Де Бройлю удалось объединить в одном соотношении корпускулярную и волновую характеристики материи – импульс и длину волны. А связывающая их постоянная Планка (величина ее приблизительно равна 6,626 × 10-27 эрг∙с или 6,626 × 10-34 Дж∙с) задает масштаб, на котором проявляются волновые свойства вещества.
«Волны материи» в микро- и макромире
Итак, чем больше импульс (масса, скорость) физического объекта, тем меньше длина волны, связанной с ним. В этом и заключается причина того, что макроскопические тела не проявляют волновой составляющей своей природы. В качестве иллюстрации достаточно будет определить длину волны де Бройля для объектов различного масштаба.
- Земля. Масса нашей планеты – около 6 × 1024 кг, скорость движения по орбите относительно Солнца – 3 × 104 м/с. Подставив эти значения в формулу, получим (приближенно): 6,6 × 10-34/(6 × 1024 × 3 × 104) = 3,6 × 10-63 м. Видно, что длина «земной волны» – исчезающе малая величина. К какой-либо возможности ее регистрации нет даже отдаленных теоретических предпосылок.
- Бактерия массой порядка 10-11 кг, движущаяся со скоростью около 10-4 м/с. Произведя аналогичный подсчет, можно узнать, что дебройлевская волна одного из мельчайших живых существ имеет длину порядка 10-19 м – также слишком мало для того, чтобы ее обнаружить.
- Электрон, имеющий массу 9,1 × 10-31 кг. Пусть электрон разогнан разностью потенциалов 1 В до скорости 106 м/с. Тогда длина электронной волны будет примерно 7 × 10-10 м, или 0,7 нанометра, что сопоставимо с длинами рентгеновских волн и вполне поддается регистрации.
Масса электрона, как и прочих частиц, настолько мала, неощутима, что заметной становится другая сторона их природы – волнообразность.
Скорость распространения
Различают такие понятия, как фазовая и групповая скорость волн. Фазовая (скорость перемещения поверхности одинаковых фаз) для волн де Бройля превышает скорость света. Этот факт тем не менее не означает противоречия с теорией относительности, поскольку фаза не относится к числу объектов, посредством которых может передаваться информация, так что принцип причинности в данном случае никоим образом не нарушается.
Групповая же скорость меньше скорости света, она связана с перемещением суперпозиции (наложения) множества волн, образованных вследствие дисперсии, и именно она отражает скорость электрона или какой-либо иной частицы, с которой связана волна.
Экспериментальное обнаружение
Величина длины волны де Бройля позволила физикам осуществить опыты, подтверждающие предположение о волновых свойствах вещества. Ответить на вопрос, реальны ли электронные волны, мог эксперимент по выявлению дифракции потока этих частиц. Для рентгеновских лучей, близких по длине волны к электронам, не подходит обычная дифракционная решетка – период ее (то есть расстояние между штрихами) слишком велик. Подходящий размер периода имеют атомные узлы кристаллических решеток.

Уже в 1927 году К. Дэвиссоном и Л. Джермером был поставлен эксперимент по обнаружению дифракции электронов. В качестве отражательной решетки использовался монокристалл никеля, при помощи гальванометра фиксировалась интенсивность рассеяния электронного пучка на разных углах. Характер рассеяния выявил четкую дифракционную картину, подтвердившую предположение де Бройля. Независимо от Дэвиссона и Джермера, в том же году дифракцию электронов опытным путем обнаружил Дж. П. Томсон. Несколько позднее появление дифракционной картины было установлено для протонных, нейтронных, атомных пучков.
В 1949 году группа советских физиков под руководством В. Фабриканта провела успешный эксперимент с использованием не пучка, а отдельных электронов, что позволило неопровержимо доказать: дифракция не является каким-либо эффектом коллективного поведения частиц, а волновые свойства принадлежат электрону как таковому.
Развитие представлений о «волнах материи»
Сам Л. де Бройль волну представлял как реальный физический объект, неразрывно связанный с частицей и управляющий ее движением, и называл ее «волной-пилотом». Однако, продолжая рассматривать частицы как объекты, обладающие классическими траекториями, он не в силах был сказать что-либо о природе таких волн.
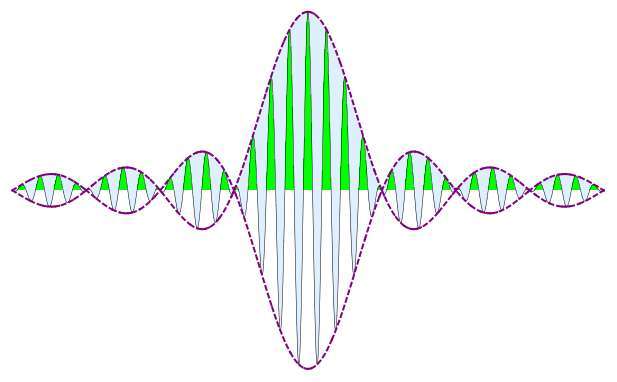
Развивая идеи де Бройля, Э. Шредингер пришел к представлениям о полностью волновой природе вещества, по сути, игнорируя корпускулярную ее сторону. Любая частица в понимании Шредингера представляет собой некий компактный волновой пакет и ничего более. Проблемой такого подхода стало, в частности, хорошо известное явление быстрого расплывания подобных волновых пакетов. В то же время частицы, например электрон, вполне стабильны и не «размазываются» по пространству.
В ходе бурных дискуссий середины 20-х годов XX века квантовая физика выработала подход, примиряющий корпускулярную и волновую картины в описании материи. Теоретически он был обоснован М. Борном, а суть его в нескольких словах можно выразить так: волна де Бройля отражает распределение вероятности нахождения частицы в определенной точке в некоторый момент времени. Поэтому ее также называют волной вероятности. Математически она описывается волновой функцией Шредингера, решение которой позволяет получить величину амплитуды этой волны. Квадрат модуля амплитуды и определяет вероятность.
Значение волновой гипотезы де Бройля
Вероятностный подход, усовершенствованный Н. Бором и В. Гейзенбергом в 1927 г., лег в основу так называемой копенгагенской интерпретации, которая стала чрезвычайно продуктивной, хотя принятие ее и далось науке ценой отказа от наглядно-механистических, образных моделей. Несмотря на наличие ряда спорных вопросов, таких как знаменитая «проблема измерения», с копенгагенской интерпретацией связано дальнейшее развитие квантовой теории с ее многочисленными приложениями.
Между тем следует помнить, что одной из основ бесспорного успеха современной квантовой физики явилась гениальная гипотеза де Бройля, теоретическое прозрение почти столетней давности о «волнах материи». Сущность его, невзирая на изменения первоначального толкования, остается неоспоримой: вся материя имеет двойственную природу, различные стороны которой, проявляясь всегда отдельно одна от другой, тем не менее тесно взаимосвязаны.