Уникально прочный и легкий бериллий используется при изготовлении сотовых телефонов, ракет и самолетов. Но при обращении с этим металлом следует быть осторожным, он считается очень токсичным.
Современное его название связано с минералом берилл, раньше он был известен как глюциниум, от греческого glykys - «сладкий», что отражало его характерный вкус. Но химики, которые обнаружили это уникальное свойство бериллия, также обнаружили, что он на самом деле очень токсичен. Также его классифицируют как канцероген, он может вызывать рак легких у людей, которые ежедневно подвергаются воздействию этого элемента из-за работ по его добыче или обработке. Но несмотря на это, он очень полезен из-за своих уникальных качеств. Например, он чрезвычайно легкий и имеет одну из самых высоких температур плавления.
 Вам будет интересно:Грамматические средства языка: понятие и примеры
Вам будет интересно:Грамматические средства языка: понятие и примеры
Характеристика бериллия
Кратко информацию о нем можно представить следующим образом:
Открытие и использование
Бериллий был обнаружен в 1798 году французским химиком Луи Николасом Вокленом в форме оксида в берилле и его разновидности, изумруде зеленого цвета. Металл был выделен в 1828 году двумя химиками - Фридрихом Веллером из Германии и Антуаном Бюсси из Франции, который независимо восстановил хлорид бериллия (BeCl2) с калием в платиновом тигле. В наши дни его обычно получают из минералов берилла и бертрандита в химическом процессе или путем электролиза смеси расплавленного хлорида бериллия и хлорида натрия.

Он содержится примерно в 30 минеральных веществах. Включая бертрандит, берилл, хризоберилл и фенацит. Первые два являются наиболее важными источниками элемента и его соединений.
Он легко легируется медью или никелем при изготовлении пружин, гироскопов, электрических контактов, электродов для точечной сварки. Другие бериллиевые сплавы используются в высокоскоростных самолетах и ракетах, а также на космических кораблях и спутниках связи. Бериллиевая медь также применяется в раме ветрового стекла, тормозных дисках, опорных балках и других конструктивных элементах космического челнока.
Благодаря низкому сечению поглощения тепловых нейтронов он используется в ядерных реакторах в качестве отражателя или замедлителя.
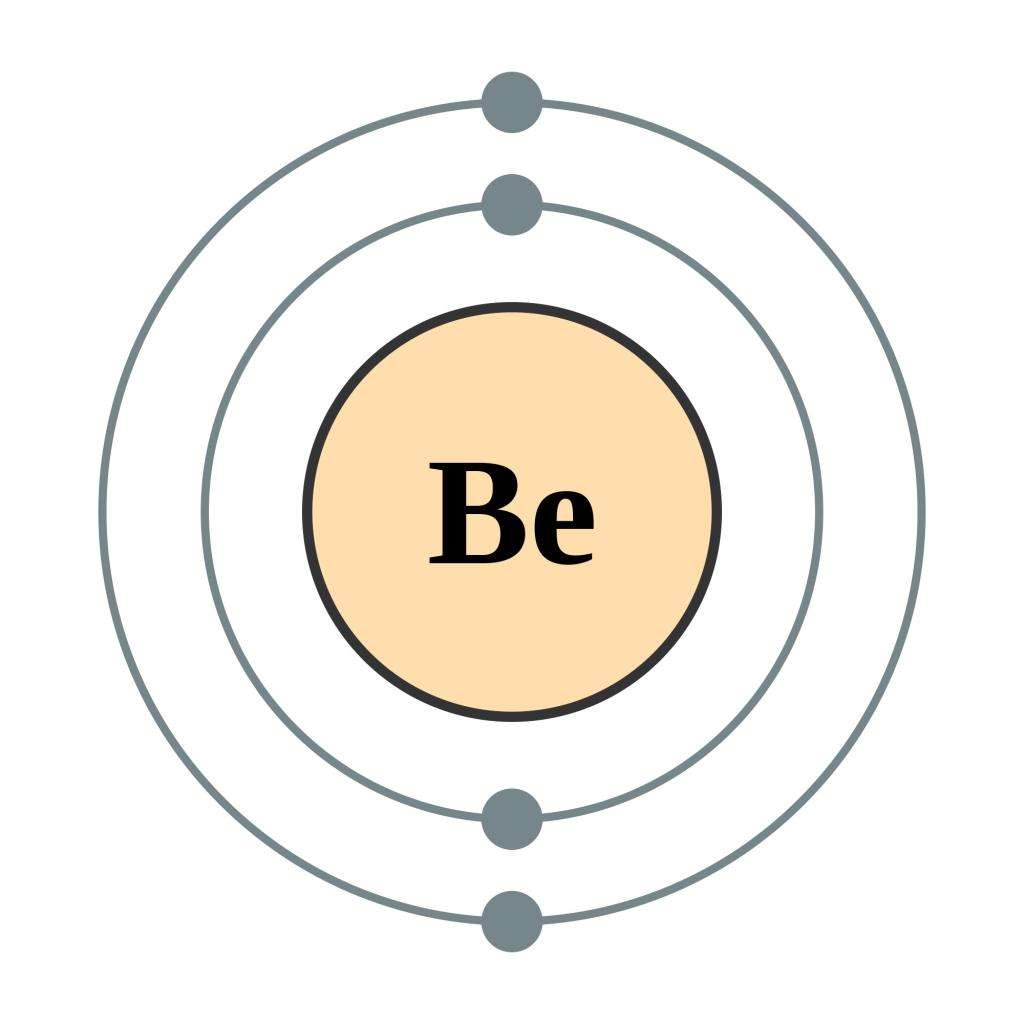
Электронная формула бериллия
В атоме электроны вращаются вокруг центра, называемого ядром. Они находятся на отдельных орбитах. Первая может содержать только 2 электрона, вторая – 8, а для первых восемнадцати элементов оболочка 3 может содержать максимум 8. Атомный номер говорит об их количестве в электронной формуле. Бериллий имеет четвертый номер. Соответственно, в его атоме 4 электрона.
При записи электронной формулы бериллия первые два электрона перейдут на орбиту 1s. Поскольку она может содержать только два, оставшиеся 2 переходят в орбиту 2s. Такое обозначение конфигурации предоставляет ученым простой способ отображения того, как электроны расположены вокруг ядра атома. Это облегчает понимание и прогнозирование взаимодействия их при образовании химических связей.
Таким образом, электронная формула бериллия будет выглядеть следующим образом: 1s 2 2s 2.
Изотопы
Элемент бериллий имеет только один стабильный изотоп 9Be. 10Be образуется в атмосфере путем расщепления космическими лучами кислорода и азота. Поскольку бериллий имеет тенденцию существовать в растворе при уровнях рН менее 5,5 (а большая часть дождевой воды имеет рН менее 5), он попадает на поверхность земли именно таким способом. Поскольку осадки быстро становятся более щелочными, элемент выпадает из раствора. Постепенно он накапливается на поверхности почвы, где период его полураспада составляет около полутора миллионов лет. 10Be используется для изучения эрозии почвы, образования реголита, развития латеритных почв, а также изменений солнечной активности и возраста ледяных кернов.
Нестабильность изотопов 7Be и 8Be означает, что они, будучи более тяжелыми, чем бериллий, не могли быть получены в результате ядерного синтеза как следствие Большого взрыва. Более того, уровень ядерной энергии бериллия-8 таков, что делает возможным образование внутри звезд углерода и, соответственно, жизни.