- Факты об алканах
- Свойства алканов
- Галогенирование алканов
- Реакции хлорирования алканов
- Стадии галогенирования
- Бромирование алканов
- Различие хлорирования и бромирования алканов
- Характер реакции хлорирования
- Характер реакции бромирования
- Сульфирование алканов
- Сульфохлорирование алканов
- Реакция Коновалова
- Реакции окисления и горения
Несмотря на то, что алканы малоактивны, они способны на выделение большого количества энергии при взаимодействии с галогенами или другими свободными радикалами. Алканы и реакции с ними постоянно используют во многих сферах промышленности.
Факты об алканах
В органической химии алканы занимают важное место. Формула алканов в химии - CnH2n+2. В отличие от ароматических веществ, у которых есть бензольное кольцо, алканы считаются алифатическими (ациклическими).
В молекуле любого алкана все элементы соединены одинарной связью. Поэтому у данной группы веществ окончание «-ан». Соответственно, у алкенов есть одна двойная связь, а у алкинов – одна тройная. У алкодиенов, например, две двойные связи.
 Вам будет интересно:Серная кислота и карбонат натрия: применение и формула
Вам будет интересно:Серная кислота и карбонат натрия: применение и формула
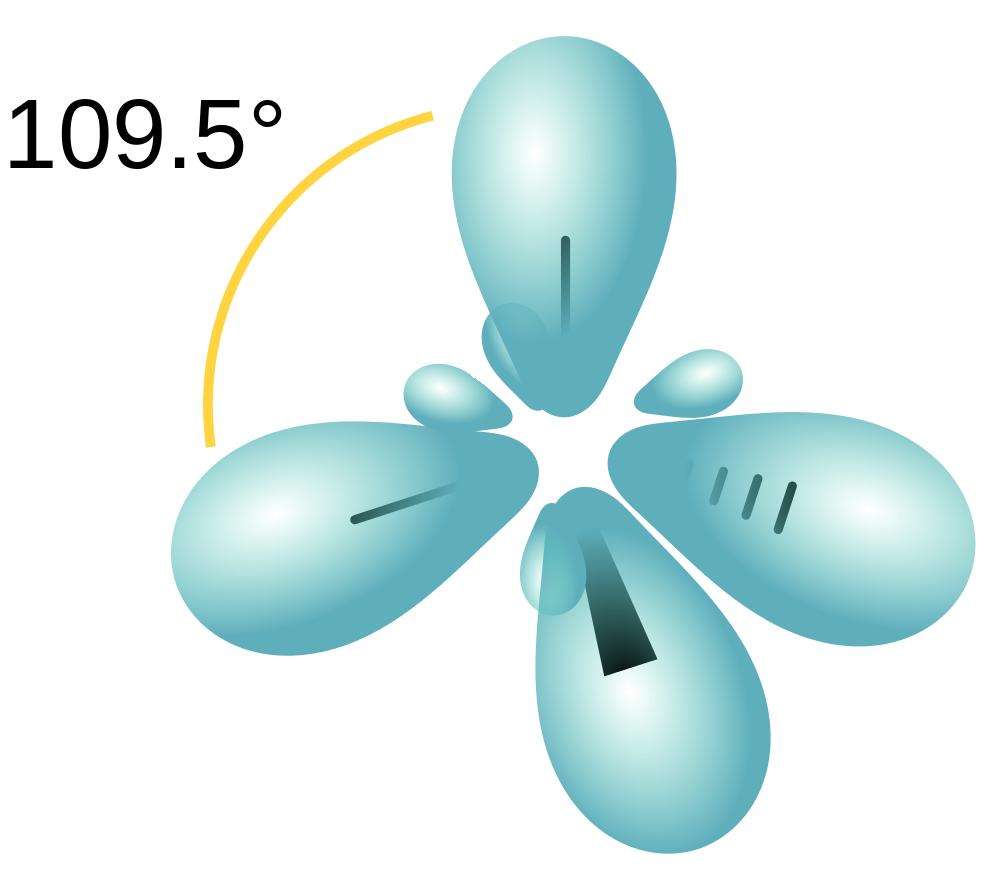
Алканы - насыщенные углеводороды. То есть в них находится максимальное количество атомов Н (водорода). Все атомы углерода в алкане состоят в положении sp3 – гибридизации. Это значит, что молекула алкана строится по правилу тетраэдра. Молекула метана (СН4) напоминает тетраэдр, а остальные алканы имеют зигзагообразную структуру.
Все атомы С в алканах соединены с помощью ơ – связи (сигма – связи). Связи С―С являются неполярными, связи С―Н – слабополярными.
Свойства алканов
Как уже говорилось выше, группа алканов обладает маленькой активностью. Связи между двумя атомами С и между атомами С и Н прочные, поэтому их сложно разрушить воздействием извне. Все связи в алканах являются ơ – связями, поэтому, если они разрываются, это обычно приводит к появлению радикалов.
 Вам будет интересно:Каково лексическое значение слова "классический"?
Вам будет интересно:Каково лексическое значение слова "классический"?
Галогенирование алканов
Ввиду особых свойств у связей атомов, алканам присущи реакции замещения и разложения. В реакциях замещения у алканов атомы водорода сменяют другие атомы или молекулы. Алканы хорошо реагируют с галогенами – веществами, находящимися в 17 группе периодической таблицы Менделеева. Являются галогенами фтор (F), бром (Br), хлор (Cl), йод (I), астат (At) и теннессин (Ts). Галогены очень сильные окислители. Они реагируют практически со всеми веществами из таблицы Д. И. Менделеева.
Реакции хлорирования алканов
На практике участие в галогенировании алканов принимают обычно бром и хлор. Фтор слишком активный элемент – с ним реакция будет взрывной. Йод - слабый, поэтому реакция замещения с ним идти не будет. А астата очень мало в природе, поэтому сложно собрать достаточное его количество для проведения экспериментов.
Стадии галогенирования
Все алканы проходят три стадии галогенирования:
Бромирование алканов
При галогенировании высших алканов, идущих после этана, сложность представляет образование изомеров. Из одного вещества под действием солнечного света могут образоваться разные изомеры. Происходит это в результате реакции замещения. Это доказательство того, что при галогенировании свободным радикалом может быть замещен любой атом Н в алкане. Сложный алкан распадается на два вещества, процентное содержание которых может сильно варьироваться в зависимости от условий реакции.

Бромирование пропана (2-бромпропан). При реакции галогенирования пропана молекулой Br2 под воздействием высоких температур и солнечного света выходят 1-бромпропан – 3 % и 2-бромпропан – 97 %.
Бромирование бутана. При бромировании бутана под действием освещения и высоких температур выходит 2 % 1-бромбутана и 98 % 2-бромбутана.
Различие хлорирования и бромирования алканов
Хлорирование чаще используют в промышленности. Например, для производства растворителей, в которых содержится смесь изомеров. При получении галогеналканы сложно отделять друг от друга, но зато на рынке смесь стоит дешевле, чем чистый продукт. В лабораториях больше распространено бромирование. Бром слабее хлора. У него низкая реакционная способность, поэтому у атомов брома высокая селективность. Это значит, что во время реакции атомы «выбирают», какой атом водорода им заменить.
Характер реакции хлорирования
При хлорировании алканов изомеры образуются примерно в равном количестве в своей массовой доле. Например, хлорирование пропана при катализаторе в виде повышения температуры до 454 градусов выдает нам 2–хлорпропан и 1-хлорпропан в соотношении 25 % и 75 % соответственно. Если реакция галогенирования проходит только при помощи ультрафиолетового излучения, 1–хлорпропана получается 43 %, а 2-хлорпропана – 57%. В зависимости от условий проведения реакции соотношение полученных изомеров может меняться.
Характер реакции бромирования
В результате реакций бромирования алканов легко выходит почти чистое вещество. Например, 1-бромпропан – 3 %, 2-бромпропан – 97% из молекулы н-пропана. Потому бромирование часто применяют в лабораториях для синтеза определенного вещества.
Сульфирование алканов
Алканы сульфируются также по механизму радикального замещения. Чтобы произошла реакция, на алкан одновременно воздействуют кислород и оксид серы SO2 (сернистый ангидрид). В итоге реакции алкан превращается в алкилсульфокислоту. Пример сульфирования бутана:
СН3СН2СН2СН3 + О2 + SO2 → CH3CH2CH2CH2SO2OH
Общая формула сульфоокисления алканов:
R―H + О2 + SO2 → R―SO2OH
Сульфохлорирование алканов
В случае сульфохлорирования вместо кислорода в качестве окислителя используется хлор. Таким способом получают алкансульфохлориды. Реакция сульфохлорирования привычна для всех углеводородов. Она происходит при комнатной температуре и солнечном освещении. Также в качестве катализатора применяют органические пероксиды. Такая реакция затрагивает только вторичные и первичные связи, относящиеся к атомам углерода и водорода. До третичных атомов дело не доходит, так как происходит обрыв цепи реакции.
Реакция Коновалова
Реакция нитрования, как и реакция галогенирования алканов, проходит по свободно-радикальному механизму. Проводят реакцию, используя сильно разбавленную (10 – 20 %) азотную кислоту (HNO3). Механизм реакции: в результате реакции алканы образуют смесь соединений. Для катализации реакции используют повышение температуры до 140⁰ и нормальное или повышенное давление окружающей среды. При нитровании разрушаются связи С―С, а не только С―Н в отличие от предыдущих реакций замещения. Это значит, что происходит крекинг. То есть реакция расщепления.
Реакции окисления и горения
По свободнорадикальному типу проходят и реакции окисления алканов. Для парафинов существует три вида переработки с помощью окислительной реакции.
В процессе окисления свободный радикал О2 полностью или частично замещает водородную составляющую. Полное окисление - это горение.

Хорошо сгорающие алканы используются как топливо для теплоэлектростанций и двигателей внутреннего сгорания. Горящие алканы производят очень много тепловой энергии. В двигатели внутреннего сгорания помещают сложные алканы. Взаимодействие с кислородом у простых алканов может привести к взрыву. Из продуктов отхода, образующихся в результате реакций с алканами, делают асфальт, парафин и различные смазки для промышленности.