Al2(SO4)3 - сульфат алюминия, неорганическое вещество из класса солей. Встречается в виде кристаллов или порошка белого цвета, хорошо растворяется в воде. Химически активное вещество, хорошо реагирует со многими компонентами, поэтому часто используется в опытах и задачах по химии, но для их решения нужно знать молярную массу Al2(SO4)3.
Расчет показателя
Относительная молекулярная масса сульфата алюминия - это объем одной отдельной молекулы этого вещества. Рассмотрим подробнее.
Показатель выражают в атомных единицах массы (а.е.м.). Ее легко высчитать при помощи периодической системы элементов Менделеева, зная формулу вещества.
 Вам будет интересно:Равновесие - это что такое?
Вам будет интересно:Равновесие - это что такое?
Для этого нужно найти в таблице элементы, из которых состоит интересующее нас вещество, - алюминий, серу и кислород. Относительная масса одного атома алюминия составляет 26,992 а.е.м. (округляем до 27), атома серы 32,064 (округляем до 32), атома кислорода 15,999 (округляем до 16).
Формула молекулы сульфата алюминия на рисунке ниже. На нем виден состав молекулы, и сколько атомов каждого элемента участвует в образовании одной условной молекулы вещества.
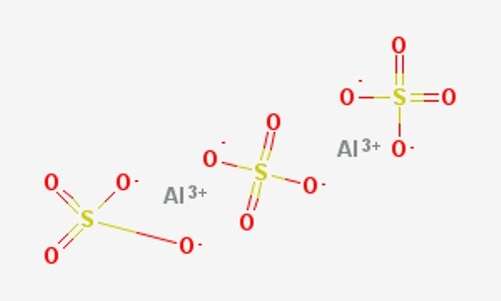
Дальше нужно умножить массу одного атома алюминия на количество этих частиц в молекуле Al2(SO4)3. Это число указано нижним индексом справа от символа алюминия - 2. Умножаем 2 на 27, получаем 54 а.е.м.
Далее повторим действия с атомом серы. В состав молекулы сульфата алюминия входит три частицы (SO4), а значит три атома серы. Умножаем 32 на 3, получаем 96 а.е.м.
Такой же расчет производим с атомами кислорода. Сначала подсчитаем, сколько их входит в состав молекулы. В ней содержатся три частицы (SO4), то есть 12 атомов кислорода. Умножаем массу на количество атомов - 16 на 12, получаем 192 а.е.м.
Последнее действие - нужно сложить массы всех составных частей молекулы:
54 + 96 + 192 = 342 а.е.м.
Итак, молекулярная масса алюминия сульфата составляет 342 а.е.м.
Следующий показатель
Молярная масса al2 so4 3 - это объем одного моля сульфата алюминия. Его очень легко узнать, так как он численно равен молекулярной массе, но выражается в других единицах измерения - г/моль.
Итак, молярная масса al2 so4 3 составляет 342 г/моль. Эта величина часто требуется для решения задач.
Молярная масса эквивалента
Для расчета этой величины нужно знать фактор эквивалентности. Он определяется по-разному для классов веществ.
Сульфат алюминия относят к группе средних солей. Для таких соединений фактор эквивалентности считается так:
Чтобы найти молярную массу эквивалента сульфата алюминия, умножим его молярную массу на фактор эквивалентности:
342 * 1 / 6 = 57 г/моль.
Итак, молярная масса эквивалента Al2 (SO4) 3 равна 57 г/моль.
Расчеты окончены, искомая величина определена.

