Изучение свойств идеального газа является важной темой в физике. Знакомство с характеристиками газовых систем начинают с рассмотрения уравнения Бойля-Мариотта, поскольку оно является первым экспериментально обнаруженным законом идеального газа. Рассмотрим его подробнее в статье.
Что понимают под идеальным газом?
Прежде чем говорить о законе Бойля-Мариотта и уравнении, которое его описывает, дадим определение идеальному газу. Под ним принято понимать текучую субстанцию, в которой составляющие ее частицы друг с другом не взаимодействуют, и их размеры пренебрежимо малы в сравнении со средними межчастичными расстояниями.
 Вам будет интересно:Что значит «вояж»? Это приятно или опасно?
Вам будет интересно:Что значит «вояж»? Это приятно или опасно?
В действительности любой газ является реальным, то есть составляющие его атомы и молекулы имеют определенный размер и между собой с помощью Ван-дер-ваальсовых сил не взаимодействуют. Однако, при высоких абсолютных температурах (больше 300 К) и низких давлениях (меньше одной атмосферы) энергия кинетическая атомов и молекул намного превышает энергию Ван-дер-ваальсовых взаимодействий, поэтому реальный газ при указанных условиях с высокой точностью может считаться идеальным.
Уравнение Бойля-Мариотта
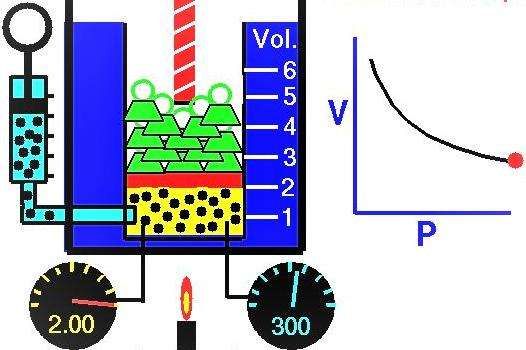
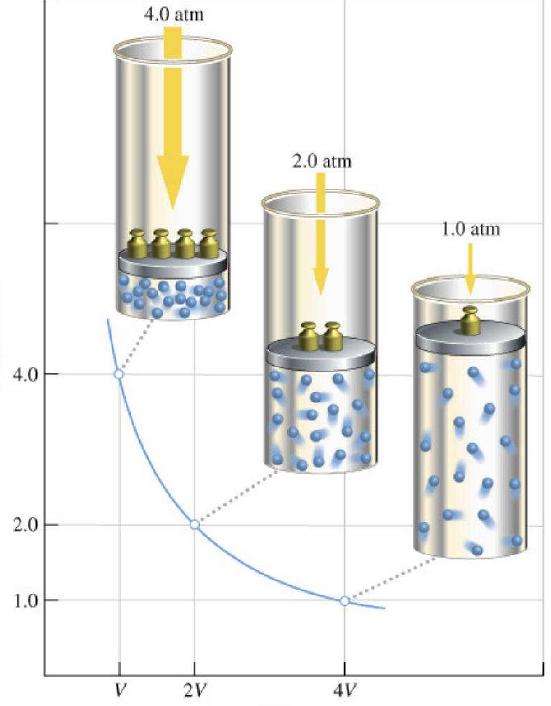
Свойства газов европейские ученые активно исследовали в течение XVII-XIX веков. Самым первым газовым законом, который был открыт экспериментально, стал закон, описывающий изотермические процессы расширения и сжатия газовой системы. Соответствующие опыты были проведены Робертом Бойлем в 1662 году и Эдмом Мариоттом в 1676 году. Каждый из этих ученых независимо показал, что во время изотермического процесса в закрытой газовой системе изменяется давление объему обратно пропорционально. Полученное экспериментально математическое выражение процесса записывается в следующем виде:
P*V = k
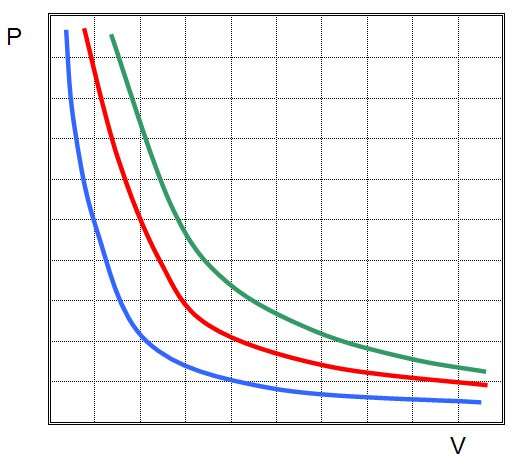
Где P и V - давление в системе и ее объем, k - некоторая постоянная, значение которой от количества вещества газа и от его температуры зависит. Если построить зависимость функции P(V) на графике, то она будет представлять собой гиперболу. Пример этих кривых показан ниже.
Записанное равенство называется уравнением (законом) Бойля-Мариотта. Этот закон кратко можно сформулировать так: расширение идеального газа при постоянной температуре приводит к пропорциональному уменьшению давления в нем, наоборот, изотермическое сжатие газовой системы сопровождается пропорциональным повышением давления в ней.
Уравнение состояния газа идеального
Бойля-Мариотта закон частным случаем является более общего закона, который носит фамилии Менделеева и Клапейрона. Эмиль Клапейрон, обобщая экспериментальную информацию поведения газов при различных внешних условиях, в 1834 году получил следующее уравнение:
P*V = n*R*T
Иными словами, произведение объема V газовой системы на давление P в ней прямо пропорционально произведению абсолютной температуры T на количество вещества n. Коэффициент этой пропорциональности обозначен буквой R и называется газовой универсальной постоянной. В записанном уравнении величина R появилась благодаря замене ряда констант, которую сделал Дмитрий Иванович Менделеев в 1874 году.
Из универсального уравнения состояния легко увидеть, что постоянство температуры и количества вещества гарантирует неизменность правой части равенства, а значит, левая часть равенства также будет оставаться постоянной. В таком случае мы получаем уравнение Бойля-Мариотта.
Другие законы газовые
Записанное в пункте выше Клапейрона-Менделеева уравнение содержит три термодинамических параметра: P, V и T. Если каждый из них фиксировать, а двум остальным позволять меняться, то мы получим уравнения Бойля-Мариотта, Шарля и Гей-Люссака. Шарля закон говорит о прямой пропорциональности между объемом и температурой для изобарного процесса, а Гей-Люссака закон утверждает, что в случае изохорного перехода давление газа растет или уменьшается абсолютной температуре прямо пропорционально. Соответствующие уравнения выглядят так:
V/T = const при P = const;
P/T = const при V = const.
Таким образом, Бойля-Мариотта закон является одним из трех основных газовых законов. Тем не менее он отличается от остальных в плане графической зависимости: функции V(T) и P(T) являются прямыми линиями, функция P(V) - это гипербола.
Пример задачи на применение Бойля-Мариотта закона
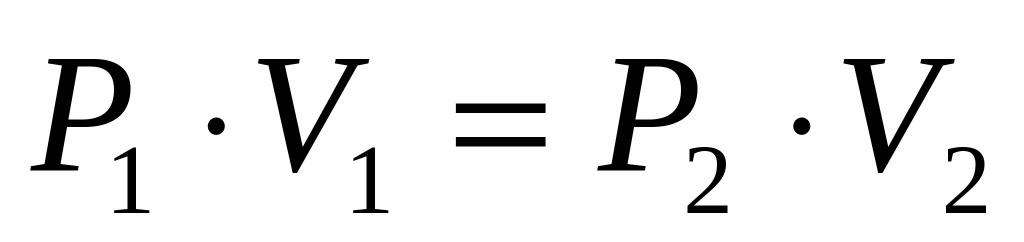
Объем газа в цилиндре под поршнем в начальном положении составлял 2 литра, и его давление было равно 1 атмосфера. Чему стало равно давление газа, после того как поршень поднялся, и объем газовой системы увеличился на 0,5 литра. Процесс считать изотермическим.
Поскольку нам даны давление и объем идеального газа, а также известно, что температура в процессе его расширения остается неизменной, то мы вправе воспользоваться уравнением Бойля-Мариотта в следующей форме:
P1*V1 = P2*V2
Это равенство говорит о том, что произведение на объем давления является постоянным для каждого состояния газа при данной температуре. Выражая из равенства величину P2, получаем конечную формулу:
P2 = P1*V1/V2
При выполнении вычислений давления можно использовать внесистемные единицы в данном случае, поскольку литры сократятся, и мы получим давление P2 в атмосферах. Подставив данные из условия, приходим к ответу на вопрос задачи: P2 = 0,8 атмосферы.