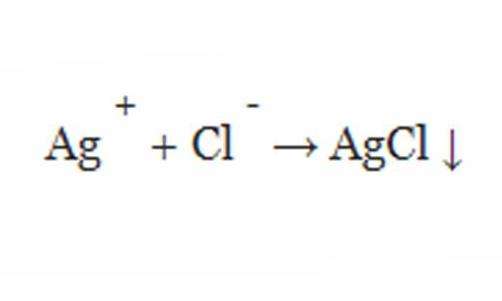- Растворимость элемента
- Перенасыщение жидкости
- Кристаллы порфирина
- Представление с использованием химических уравнений
- Осадки различных цветов
- Анионный и катионный анализ
- Процесс пищеварения
- Свойства различных осадков
- Взаимодействие осаждения и двойной замены
- Правила растворимости, скорость осаждения
- Чистые ионные уравнения
- Приложения и примеры
- Первый пример
- Общее решение задач
- Нет реакции осадков
- Решения
- Химический процесс
- Ключевые выводы: определение осадков в химии
- Осадок против осаждения, понятийный аппарат
- Еще один пример образования связи
- Использование осадков
- Как восстановить осадок
- Старение осадков
Осаждение — это создание твердого вещества из раствора. Первоначально реакция происходит в жидком состоянии, после чего образовывается некая субстанция, которая и называется «осадком». Химический компонент, вызывающий его образование, имеет такой научный термин, как «осадитель». Без достаточной силы тяжести (отстаивания), чтобы свести жесткие частицы вместе, осадок остается в суспензии.
После осаждения, особенно при использовании центрифуги для прессования в компактную массу, осадок можно назвать «гранулой». Он может быть использован в качестве среды. Оставшаяся над твердым веществом жидкость без осадков называется «супернатант». Осаждение — это порошки, полученные из остаточных пород. Они также исторически были известны как «цветы». Когда твердое вещество появляется в форме целлюлозных волокон, прошедших химическую обработку, этот процесс часто называют регенерацией.
Растворимость элемента
 Вам будет интересно:Приторно-сладкий – это любезный притворщик или плохой обманщик?
Вам будет интересно:Приторно-сладкий – это любезный притворщик или плохой обманщик?
Иногда образование осадка указывает на возникновение какой-либо химической реакции. Если осаждение из растворов нитрата серебра выливают в жидкость хлорида натрия, то происходит химическая рефлексия с образованием белого осадка из драгоценного металла. Когда же жидкий йодид калия реагирует с веществом нитрата свинца (II), образуется желтый осадок иодида свинца (II).
Осаждение может произойти, если концентрация соединения превышает его растворимость (например, при смешивании различных компонентов или изменении их температуры). Полное осаждение может происходить быстро только из пересыщенного раствора.
В твердых веществах процесс происходит, если концентрация одного продукта выше предела растворимости в другом теле-хозяине. Например, из-за быстрого охлаждения или ионной имплантации температура достаточно высока, чтобы диффузия могла привести к разделению веществ и образованию осадка. Полное осаждение в твердых телах обычно используется для синтеза нанокластеров.
Перенасыщение жидкости
 Вам будет интересно:Пекло - это что такое? Значение слова
Вам будет интересно:Пекло - это что такое? Значение слова
Важный этап процесса осаждение — это начало зарождения. Создание гипотетической твердой частицы включает в себя формирование границы раздела, которые, конечно же, требуют некоторой энергии, основанной на относительном поверхностном движении как твердого тела, так и раствора. Если подходящая структура зародышеобразования недоступна, происходит перенасыщение.
Пример осаждения: медь из проволоки, которая вытесняется серебром в раствор нитрата метала, в который она и окунается. Конечно же, после данных экспериментов твердый материал выпадает в осадок. Реакции осаждения могут быть использованы для получения пигментов. А также для удаления солей из воды при ее обработке и в классическом качественном неорганическом анализе. Именно так происходит осаждение меди.
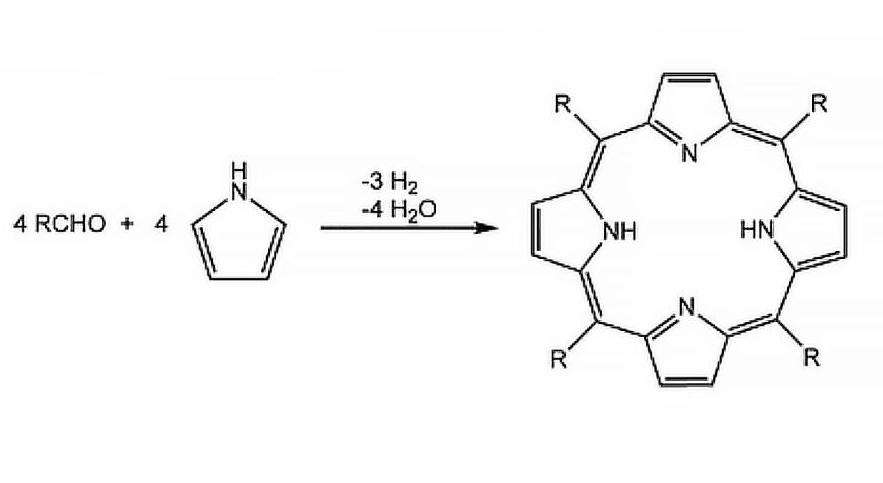
Кристаллы порфирина
Осадки также полезны во время выделения продуктов реакции, когда происходит обработка. В идеале данные вещества нерастворимы в реакционном компоненте.
Таким образом твердое вещество выпадает в осадок по мере его образования, предпочтительно создавая чистые кристаллы. Примером этого может служить синтез порфиринов в кипящей пропионовой кислоте. При охлаждении реакционной смеси до комнатной температуры кристаллы этого компонента выпадают на дно сосуда.
Осаждение осадков также может происходить при добавлении антирастворителя, что резко снижает абсолютную водность желаемого продукта. После этого твердое вещество можно легко отделить фильтрацией, декантированием или центрифугированием. Примером может служить синтез хлорида хрома тетрафенилпорфирина: вода добавляется к реакционному раствору ДМФА, и продукт осаждается. Осаждение также полезно при очистке всех компонентов: неочищенный бдим-cl полностью распадается в ацетонитриле и сбрасывается в этилацетат, где он осаждается. Еще одним важным применением антирастворителя является осаждение этаноломиз ДНК.
В металлургии осаждение из твердого раствора также является полезным способом упрочнения сплавов. Этот процесс распада известен как укрепление твердого компонента.
Представление с использованием химических уравнений
 Вам будет интересно:Червяк - это насекомое или нет? Типы червяков и особенности, присущие каждому из них
Вам будет интересно:Червяк - это насекомое или нет? Типы червяков и особенности, присущие каждому из них
Пример реакции осаждения: водный нитрат серебра (AgNO 3) добавляют к раствору, содержащему хлорид калия (KCl), наблюдается распад белого твердого вещества, но уже серебра (AgCl).
Он, в свою очередь, образовал стальной компонент, который наблюдается в виде осадка.
Эта реакция осаждения может быть записана с акцентом на диссоциированные молекулы в объединенном растворе. Это называется ионный уравнением.
Последний способ создания такой реакции известен как чистая связь.
Осадки различных цветов
Зеленые и красновато-коричневые пятна на образце керна известняка соответствуют твердым веществам оксидов и гидроксидов Fe 2+ и Fe 3+.
Многие соединения, содержащие металлические ионы, производят осадки с отличительными цветами. Ниже приведены типичные оттенки для различных осаждений металлов. Однако многие из этих соединений могут давать цвета, сильно отличающиеся от перечисленных.
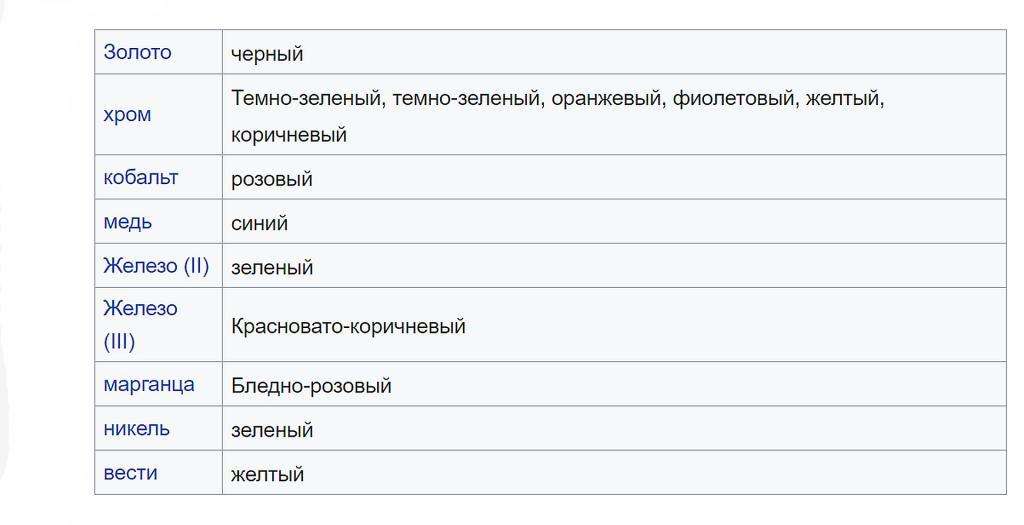
Другие объединения обычно образуют белые осадки.
Анионный и катионный анализ
Образование осадка полезно при обнаружении типа катиона в соли. Для этого щелочь сначала реагирует с неизвестным компонентом с образованием твердого вещества. Это осаждение гидроксида данной соли. Для идентификации катиона отмечают цвет осадка и его растворимость в избытке. Подобные процессы часто используются в последовательности — например, смесь нитрата бария будет реагировать с сульфат-ионами с образованием твердого осадка сульфата бария, что указывает на вероятность того, что вторые вещества присутствуют в достатке.
Процесс пищеварения
Старение осадка происходит, когда в растворе, из которого он выпадает, остается только что образовавшийся компонент, обычно при более высокой температуре. Это приводит к более чистым и крупным осаждениям частиц. Физико-химический процесс, лежащий в основе пищеварения, называется созреванием по Оствальду. Здесь можно привести в качестве примера осаждение белков.
Данная реакции совершаются, когда катионы и анионы в гидрофитном растворе соединяются с образованием нерастворимого гетерополярного твердого элемента, именуемого осадком. Совершается ли подобная реакция или отсутствует, возможно установить, применяя принципы водности для общих молекулярных твердых веществ. Поскольку не все водные реакции образуют осадки, необходимо ознакомиться с правилами растворимости, прежде чем определять состояние продуктов и писать суммарное ионное уравнение. Возможность прогнозировать эти реакции позволяет ученым определять, какие ионы присутствуют в растворе. А также это помогает промышленным предприятиям образовывать химические вещества путем извлечения компонентов из этих реакций.
Свойства различных осадков
Они представляют собой нерастворимые ионные твердые продукты реакции, образующиеся при объединении определенных катионов и анионов в водном растворе. Определяющие факторы образования осадка могут варьироваться. Некоторые реакции зависят от температуры, например, растворы, используемые для буферов, тогда как другие имеют связь только с концентрацией раствора. Твердые вещества, образующиеся в реакциях осаждения, являются кристаллическими компонентами и могут быть суспензированы во всей жидкости или упасть на дно раствора. Оставшаяся вода называется надосадочной. Два элемента консистенции (осадок и супернатант) могут быть распределены разными методами, такими как фильтрование, ультрацентрифугирование либо сцеживание.
Взаимодействие осаждения и двойной замены
Применение законов растворимости требует представления того, как реагируют ионы. Большая часть взаимодействий осаждения представляют собой процесс однократного замещения или двойного. Первый вариант происходит тогда, когда два ионных реагента диссоциируют и связываются с соответствующим анионом или катионом другого вещества. Молекулы заменяют друг друга на основе своих зарядов в виде катиона или аниона. Это можно рассматривать как «переключение партнеров». То есть каждый из двух реагентов «теряет» своего компаньона и образует связь с другим, так, например, происходит химическое осаждение сероводородом.
 Вам будет интересно:Свойства правильной призмы. Формулы площади, объема и длины диагоналей для треугольной, четырехугольной и шестиугольной фигур
Вам будет интересно:Свойства правильной призмы. Формулы площади, объема и длины диагоналей для треугольной, четырехугольной и шестиугольной фигур
Реакция двойной замены конкретно классифицируется как процесс отвердения, когда рассматриваемое химическое уравнение возникает в водном растворе, и один из образовавшихся продуктов является нерастворимым. Пример такого процесса приведен ниже.
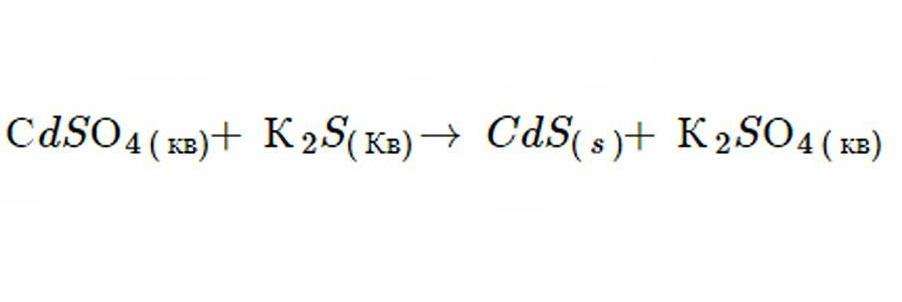
Оба реагента являются водными и один продукт - твердым. Поскольку все компоненты ионные и жидкие, они диссоциируют и поэтому могут полностью растворяться друг в друге. Однако существует шесть принципов водности, которые используются для прогнозирования того, какие молекулы нерастворимы при осаждении в воде. Эти ионы образуют твердый осадок в общей смеси.
Правила растворимости, скорость осаждения
Является ли реакция образования осадка диктуемым правилом водности веществ? На самом деле все эти законы и догадки предоставляют руководящие указания, которые сообщают, какие ионы образуют твердые вещества, а какие остаются в их первоначальной молекулярной форме в водном растворе. Правила должны соблюдаться сверху вниз. Это означает, что, если что-то неразрешимо (или разрешимо) из-за уже первого постулата, оно имеет приоритет над следующими указаниями с более высоким порядковым номером.
Бромиды, хлориды и йодиды растворимы.
Соли, содержащие осаждение серебра, свинца и ртути, невозможно смешать полностью.

Если в правилах указано, что молекула растворима, то она остается в водной форме. Но если компонент является несмешиваемым в соответствии с законами и постулатами, описанными выше, то он образует твердое вещество с предметом или жидкостью из другого реагента. Если показано, что все ионы в какой-либо реакции растворимы, то процесс осаждения не происходит.
Чистые ионные уравнения
Чтобы понять определение данного понятия, необходимо вспомнить закон для реакции двойной замены, который был приведен выше. Поскольку эта конкретная смесь является методом осаждения, состояния материи могут быть назначены для каждой переменной пары.
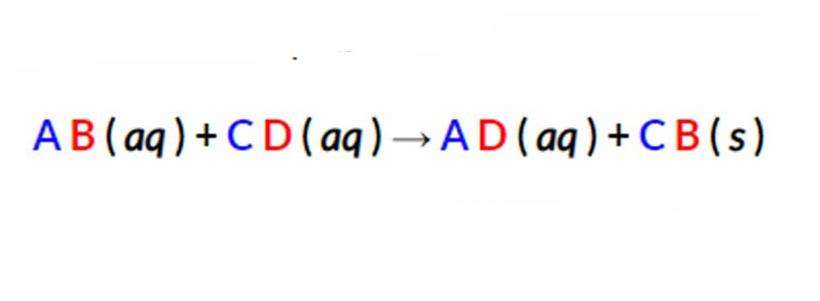
Первым шагом к написанию чистого ионного уравнения является разделение растворимых (водных) реагентов и продуктов на их соответствующие катионы и анионы. Осадки не растворяются в воде, поэтому твердое вещество не должно отделяться. Полученное правило выглядит следующим образом.

В приведенном выше уравнении ионы A+ и D - присутствуют с обеих сторон формулы. Их еще называют молекулами-зрителями, потому что они остаются неизменными на протяжении всей реакции. Поскольку именно они проходят через уравнение без изменений. То есть их можно исключить, чтобы показать формулу безупречной молекулы.
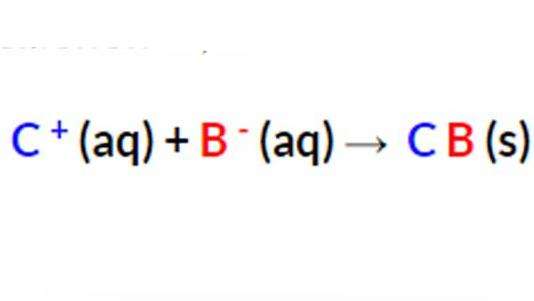
Чистое ионное уравнение показывает только реакцию осаждения. А сетевая молекулярная формула должна быть обязательно сбалансирована с обеих сторон не только с точки зрения атомов элементов, но и если рассматривать их со стороны электрического заряда. Реакции осадков обычно представлены исключительно ионными уравнениями. Если все продукты являются водными, чистая молекулярная формула не может быть записана. А происходит это потому, что все ионы исключены как продукты зрителя. Поэтому никакой реакции осаждения, естественно, не происходит.
Приложения и примеры
Реакции осаждения полезны при определении того, присутствует ли тот самый необходимый элемент в растворе. Если осадок образуется, например, когда химическое вещество вступает в реакцию со свинцом, присутствие этого компонента в водных источниках может быть проверено путем добавления химического вещества и контроля образования осадка. Кроме того, рефлексия осаждения может быть использована для извлечения элементов, таких как магний, из морской воды. Реакции осадков даже происходят в организме человека между антителами и антигенами. Однако среда, в которой это случается, все еще изучается учеными со всего света.
Первый пример
Необходимо завершить реакцию двойной замены, а затем свести ее к уравнению чистого иона.
Во-первых, необходимо предсказать конечные продукты этой реакции, используя знания о процессе двойной замены. Для этого нужно помнить, что катионы и анионы «переключают партнеров».
Во-вторых, стоит разделить реагенты на их полноценные ионные формы, поскольку они существуют в водном растворе. И также не стоит забывать сбалансировать как электрический заряд, так и общее количество атомов.
Наконец, нужно включить все ионы зрителя (те самые молекулы, которые встречаются по обеим сторонам формулы, которые не изменились). В данном случае это такие вещества, как натрий и хлор. Конечное ионное уравнение выглядит так.

Необходимо также завершить реакцию двойной замены, а затем опять же обязательно свести ее к уравнению чистого иона.
Общее решение задач
Предсказанными продуктами этой реакции являются CoSO4 и NCL из правил растворимости, COSO4 полностью распадается, потому что пункт 4 гласит, что сульфаты (SO2–4) не оседают в воде. Точно так же нужно обнаружить, что компонент NCL разрешим на основе постулата 1 и 3 (в качестве доказательства можно привести только первый отрывок). После балансировки полученное уравнение имеет следующий вид.
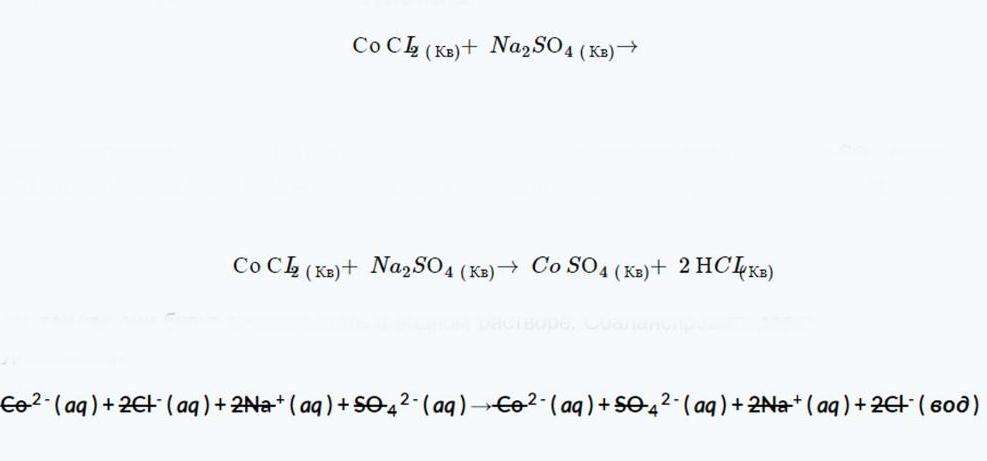
Для дальнейшего шага стоит разделить все компоненты на их ионные формы, так как они будут существовать в водном растворе. А также сбалансировать заряд и атомы. После чего отменить все ионы зрителя (те, которые появляются как компоненты с обеих сторон уравнения).
Нет реакции осадков
Этот конкретный пример важен, потому что все реагенты и продукты являются водными, что означает, что они исключаются из чистого ионного уравнения. Там не образуется твердого осадка. Следовательно, никакой реакции осаждения не происходит.
Необходимо написать суммарное ионное уравнение для потенциально двойных реакций смещения. Обязательно стоит включить в решение состояние материи, это поможет достичь баланса в общей формуле.
Решения
1. Независимо от физического состояния, продукты этой реакции являются Fe(ОН)3 и NO3. Правила растворимости предсказывают, что NO3 полностью распадается в жидкости, потому что все нитраты являются таковыми (это доказывает второй пункт). Тем не менее Fe (О Н)3 нерастворим, потому что осаждение ионов гидроксидов всегда имеют такую форму (в качестве доказательства можно привести шестой постулат) и Fe не является одним из катионов, что приводит к исключению компонента. После диссоциации уравнение имеет следующий вид:
2. В результате реакции двойной замены продукты представляют собой Al, CL3 и Ba, SO4, AlCL3 растворим, потому что содержит хлорид (правило 3). Однако B a S О4 не распадается в жидкости, так как компонент имеет в своем составе сульфат. Но В 2 + ион делает его также нерастворимым, потому что это один из катионов, который вызывает исключение из четвертого правила.
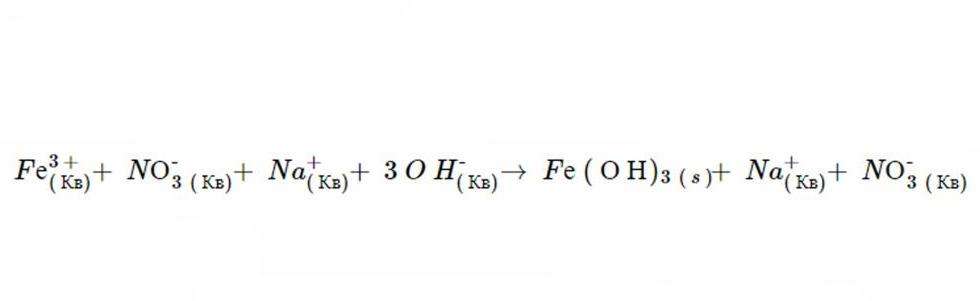
Именно так выглядит конечное уравнение после балансировки. А при удалении зрительских ионов получается уже следующая сетевая формула.
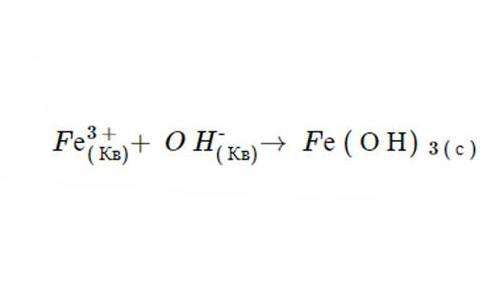
3. Из реакции двойной замены, продукты HNO3, а также ZnI2 образуются. Согласно правилам, HNO3 распадается, потому что содержит нитрат (второй постулат). И Zn I2 также растворим, потому что йодиды являются такими же (пункт 3). Это означает, что оба продукта являются водными (то есть диссоциируют в любой жидкости) и таким образом никакой реакции осаждения не происходит.
4. Продуктами этой двойной рефлексии замещения являются C a3(РО4)2 и N CL. Правило 1 гласит, что N CL растворим, и в соответствии с шестым постулатом, C a3(РО4)2 не распадается.
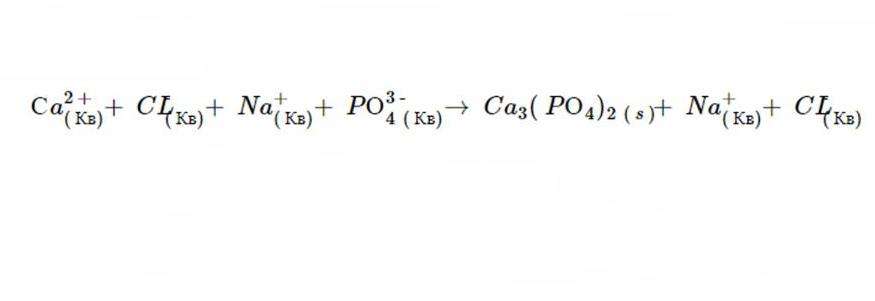
Именно такой вид будет иметь ионное уравнение, когда реакция завершится. А после исключения осаждений получается вот такая формула.
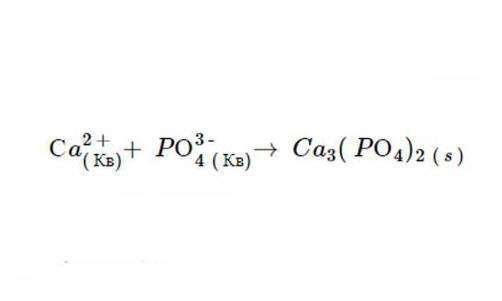
5. Первый продукт этой реакции, PbSO4, растворим в соответствии с четвертым правилом, потому что это сульфат. Второй продукт KNO3 также распадается в жидкости, потому что содержит нитрат (второй постулат). Поэтому никакой реакции осаждения не происходит.
Химический процесс
 Вам будет интересно:Псевдослучайное число: методы получения, достоинства и недостатки
Вам будет интересно:Псевдослучайное число: методы получения, достоинства и недостатки
Данное действие отделения твердого вещества при осаждении из растворов, происходит либо путем преобразования компонента в нераспадающуюся форму, либо путем изменения состава жидкости, чтобы уменьшить качество предмета в нем. Различие между осаждением и кристаллизацией в значительной степени заключается в том, делается ли акцент на процессе, посредством которого растворимость уменьшается, или на том, благодаря чему структура твердого вещества становится организованной.
В некоторых случаях селективные осадки могут быть использованы для удаления помех из смеси. К раствору добавляют химический реагент, и он избирательно реагирует с интерференцией, образуя осадок. Затем его можно физически отделить от смеси.
Осадки часто используются для удаления металлических ионов из водных растворов: ионы серебра, присутствующие в жидком солевом компоненте, таком как нитрат серебра, который осаждают добавлением молекул хлора, при условии, например, что будет использован натрий. Ионы первого компонента и второго объединяются, образуя хлорид серебра, соединение, которое не растворяется в воде. Точно так же молекулы бария преобразовываются при осаждении кальция оксалатом. Были разработаны схемы для анализа смесей ионов металлов путем последовательного применения реагентов, которые осаждают конкретные вещества или их связанные группы.
Во многих случаях можно выбрать любое условия, при которых вещество осаждается в очень чистой и легко отделяемой форме. Выделение таких осадков и определение их массы представляют собой точные методы осаждения, нахождения количества различных соединений.
При попытках отделения твердого вещества из раствора, содержащего несколько компонентов, нежелательные составляющие часто включаются в кристаллы, что снижает их чистоту и ухудшает точность анализа. Такое загрязнение можно уменьшить, выполняя операции с разбавленными растворами и медленно добавляя осаждающий агент. Эффективная техника называется гомогенным осаждением, при котором он синтезируется в растворе, а не добавляется механически. В трудных случаях может возникнуть необходимость изолировать загрязненный осадок, повторно растворить его, и также осадить. Большая часть мешающих веществ удаляется в исходном компоненте, а вторая попытка проводится при их полном отсутствии.
Кроме того, название реакции дается по твердому компоненту, которое образуется в результате реакции осаждения.
Чтобы повлиять на распад веществ в соединении, необходим осадок с образованием нерастворимого соединения, либо созданный путем взаимодействия двух солей или изменения температуры.
Данное осаждение ионов может указывать на то, что произошла химическая реакция, но это также может случиться, если концентрация растворенного вещества превышает его долю полного распада. Действие предшествует событию, называемому зародышеобразованием. Когда небольшие нерастворимые частицы агрегируют друг с другом или образуют верхнюю часть раздела с поверхностью, такой как стенка контейнера или затравочный кристалл.
Ключевые выводы: определение осадков в химии
В этой науке, данный компонент является и глаголом, и существительным. Осаждение - это образование некоторого нерастворимого соединения либо путем снижения полного распада совмещения, либо через взаимодействия двух солевых компонентов.
Твердое вещество выполняет важную функцию. Так как оно образуется в результате реакции осаждения и называется осадком. Твердое вещество используется для очистки, удаления или извлечения солей. А также для изготовления пигментов и идентификации веществ в качественном анализе.
Осадок против осаждения, понятийный аппарат
Терминология может показаться немного запутанной. Вот как это работает: образование твердого вещества из раствора называется осадком. А химический компонент, который пробуждает жесткий распад в жидком состоянии, именуется осадителем. Если размер частиц нерастворимого соединения очень мал или силы тяжести недостаточны для вытягивания кристаллического компонента на дно контейнера, осадок может быть равномерно распределен по жидкости, образуя суспензию. Седиментация относится к любой процедуре, которая отделяет осадок от водной части раствора, которая называется супернатантом. Распространенным методом седиментации является центрифугирование. Как только осадок извлечен, полученный порошок можно назвать «цветком».
Еще один пример образования связи
Смешивание нитрата серебра и хлорида натрия в воде вызовет выпадение хлорида серебра из раствора в виде твердого вещества. То есть в этом примере осадок представляет собой ХС.
При написании химической реакции присутствие выпадения может быть обозначено следующей научной формулой со стрелкой вниз.
Использование осадков
Данные компоненты могут быть использованы для идентификации катиона или аниона в соли как часть качественного анализа. Известно, что переходные металлы образуют различные цвета осадков в зависимости от их элементарной идентичности и степени окисления. Реакции осаждения в основном используются для удаления солей из воды. А также для выделения продуктов и для приготовления пигментов. В контролируемых условиях реакция осаждения дает чистые кристаллы осадка. В металлургии они используются для упрочнения сплавов.
Как восстановить осадок
Есть несколько метод осаждения, используемых для извлечения твердого вещества:
Старение осадков
Процесс, называемый вывариванием, происходит, когда свежему твердому веществу дают оставаться в своем растворе. Обычно температура всей жидкости повышается. Импровизированное пищеварение может производить более крупные частицы с высокой чистотой. Процесс, который приводит к этому результату, известен как "созревание Оствальда".