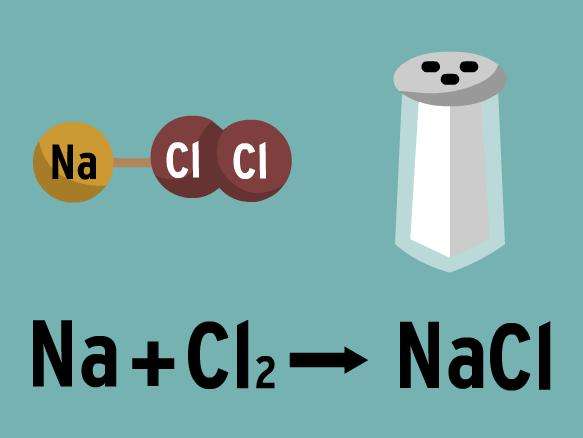Ни один процесс в мире не возможен без вмешательства химических соединений, которые, реагируя между собой, создают основу для благоприятных условий. Все элементы и вещества в химии классифицируются в соответствии со строением и функциями, которые они выполняют. Основными являются кислоты и основания. При их взаимодействии образуются растворимые и нерастворимые соли.
Примеры кислот, солей
Кислота – сложное вещество, которое в своем составе содержит один или более атомов водорода и кислотный остаток. Отличительным свойством таких соединений является способность заменить водород металлом или каким-либо положительным ионом, в результате чего происходит образование соответствующей соли. Практически все кислоты, за исключением некоторых (H2SiO3 – кремниевая кислота), растворимы в воде, причем сильные, такие как HCl (соляная), HNO3 ( азотная), H2SO4 ( серная), полностью распадаются на ионы. А слабые (например, HNO2 – азотистая, H2SO3 – сернистая) – частично. Их водородный показатель (pH), определяющий активность ионов водорода в растворе, меньше 7.
 Вам будет интересно:Сванские башни: что это и для чего они строились?
Вам будет интересно:Сванские башни: что это и для чего они строились?
Соль – сложное вещество, состоящее чаще всего из катиона металла и аниона кислотного остатка. Обычно она получается при реагировании кислот и оснований. В результате такого взаимодействия еще выделяется вода. В качестве катионов соли могут служить, например, катионы NH4+. Они, так же как и кислоты, могут растворяться в воде с различной степенью растворимости.
Примеры солей в химии: СаСО3 – карбонат кальция, NaCl – хлорид натрия, NH4Cl – хлорид аммония, K2SO4 – сульфат калия и другие.
Классификация солей
В зависимости от количества замещения катионов водородов выделяют следующие категории солей:
В зависимости от количества присутствующих в составе соли катионов и анионов различают:
Получение солей
Эти вещества получаются главным образом при реагировании щелочи с кислотой, в результате чего образуется вода: LiOH + HCl = LiCl + H2O.
При взаимодействии кислотного и основного оксидов также образуются соли: СаО + SO3 = CaSO4.
Они же получаются при вступлении в реакцию кислоты и металла, который стоит до водорода в электрохимическом ряду напряжений. Как правило, это сопровождается выделением газа: H2SO4 + Li = Li2SO4 + H2.
При взаимодействии оснований (кислот) с кислотными (основными) оксидами образуются соответствующие соли: 2KOH + SO2 = K2SO3 + H2O; 2HCl + CaO = CaCl2 + H2O.
Основные реакции солей
При взаимодействии соли и кислоты получается другая соль и новая кислота (условием такой реакции является то, что в результате должен выпасть осадок или выделиться газ): HCl + AgNO3 = HNO3 + AgCl.
При реагировании двух разных растворимых солей получают: CaCl2 + Na2CO3 = CaCO3 + 2NaCl.
Некоторые плохо растворимые в воде соли обладают способностью разлагаться на соответствующие продукты реакции при нагревании: СаСО3 = СаО + СО2.
Некоторые соли могут подвергаться гидролизу: обратимо (если это соль сильного основания и слабой кислоты (CaCO3) или сильной кислоты и слабого основания (CuCl2)) и необратимо (соль слабой кислоты и слабого основания (Ag2S)). Соли сильных оснований и сильных кислот (KCl) не гидролизуются.
Они также могут диссоциировать на ионы: частично или полностью, в зависимости от состава.